Dimethyl Sulfoxide Oxidations
Dimethyl sulfoxide-based oxidation of primary alcohols to aldehydes or secondary alcohols to ketones is a mild method that does not depend upon heavy metal oxidants. Here is a brief, chronological history of the procedure.
Index:
-
Swern Oxidation (trifluoroacetic anhydride)
-
Swern Oxidation (oxalyl chloride)
Kornblum Oxidation: (1959) az elsődleges tozilátot 150o-on melegítjük, hogy SN2 elmozdulást okozzon a dimetil-szulfoxid (DMSO) oxigénje nahco jelenlétében3. Az akkor elfogadott Mechanizmus Az E2 elimináció volt, amint az látható. A dimetil-szulfid (DMS) a reakció redukciós terméke. Ez a munka az alkil-jodidból a tozilátot ezüst-toziláttal képezte. Feltehetően a tozilát előállítható az alkoholból, amely közvetlenebb út. Az eljárás hátránya az emelkedett hőmérséklet, bár az érintkezési idő csak néhány perc. Az alapvető kérdés a szulfenátsó előállítására szolgáló módszer megtalálása.

Barton módosítás: (1964) Barton és munkatársai képesek voltak szulfenát sókat előállítani alkil-kloroformátok DMSO-val történő kezelésével CO2 veszteséggel. A trietil-amin hozzáadása oxidációs terméket hoz létre. Ez az eljárás enyhítette a Kornblum-eljárás zord körülményeit. Ezenkívül a kloroformát könnyen elérhető az oxidálandó alkohol felesleges foszgénnel történő kezelésével.

Moffatt-Pfitzner Oxidáció: (1963) a dimetil-szulfoxid-alapú oxidáció ezen változatát a Syntexnél fejlesztették ki. Az aktivátort diciklohexil-karbodiimid (1, DCC) protonálásával állítjuk elő, amelyet dimetil-szulfoxid támad meg. A 2 köztiterméket ismét protonáljuk, hogy megkönnyítsük az alkohol oxigén hozzáadását a kénatomra. Stabil diciklohexil-karbamid 4 képződik a 3 szulfenátsóval együtt. Ez a faj a dihidrogénfoszfát-anion hatására összeomlik a karbonilvegyülettel. Bár a foszforsav hatékony savkatalizátor erre a reakcióra, a kénsav,a hidrogén-klorid és a trifluor-ecetsav nem. A piridinium-trifluor-acetát azonban hatékony katalizátor. Kritikus fontosságú, hogy a sav konjugált bázisa elég bázikus legyen a reakció utolsó lépésének végrehajtásához.

Torrsell mechanizmus: (1966) Torrsell svéd kémikus bebizonyította, hogy ezeknek a DMSO-alapú oxidációknak a mechanizmusa nem intermolekuláris úton halad tovább. Az elimináció intramolekuláris folyamat. Az 5 szulfenátsót Moffatt-Pfitzner eljárással állítottuk elő (lásd fent). A Kornblum-mechanizmus alkalmazása esetén a kapott dimetil-szulfid deutériummentes lenne (1.Kísérlet). Azonban dimetil-szulfidot-d1 (7) kaptunk. Ez az eredmény összhangban van egy olyan bázissal, amely deprotonálja a kénképző ilid 6-hoz kapcsolódó metilcsoportot. Az ilid intramolekuláris deprotonációval bomlik a megfigyelt termékek előállításához.
kísérlet 1:

ennek a mechanizmusnak a megerősítésére a deutériumot DMSO-ként beépítették DMSO-d6. Ennek megfelelően a reakció során dimetil-szulfid-d5(12) és tisztítatlan aldehid-11 keletkezett (2.Kísérlet).
kísérlet 2:

Parikh-Doering oxidáció: (1967) ez az oxidáció a piridin-kén-trioxid komplexet (13) használja a dimetil-szulfoxid aktivátoraként. A szulfát a távozó csoport az alkohol (primer vagy szekunder) elmozdulásában a közbenső 14-ben. A 15-szulfenátot a intramolekuláris mechanizmus (vide supra)aldehid vagy keton előállítására.

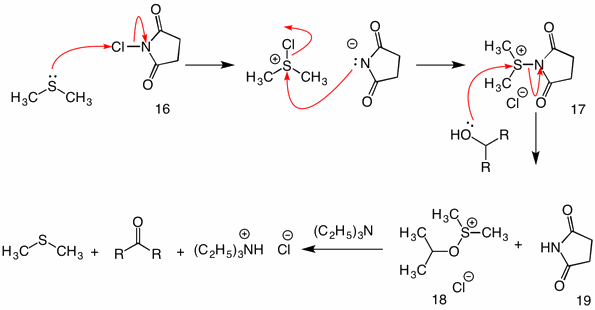
Corey-Kim Oxidáció: (1972) ebben az eljárásban a dimetil-szulfidot n-klór-szukcinimiddel (16) aktiváljuk (oxidáljuk) a 17 reagens előállításához. Ennek a fajnak az alkohollal való reakciójában a szukcinimidilcsoport kilépő csoportként működik. A szokásos 18 szulfenát köztitermék az intramolekuláris mechanizmus révén összeomlik trietil-amin hozzáadásával.
Swern oxidáció: (1976) ez a korai Swern oxidáció trifluor-ecetsav-anhidridet (20) alkalmaz-50oc a dimetil-szulfoxid aktiválásához. Az alkohol hozzáadása a 21 köztitermékhez a kívánt 22 szulfenátot eredményezi. A ketont vagy aldehidet a szokásos módon állítják elő trietil-aminnal.

Swern Oxidation: (1978) ez a későbbi Swern eljárás kényelmes módszer a 24 reagens előállítására dimetil-szulfid és klór használata nélkül. A dimetil-szulfoxid, amely ugyanolyan oxidációs szinten van, mint a 24 só, oxalil-kloriddal (23) reakcióba lép, hogy szén-monoxidot, szén-dioxidot és 24 reagenst szabadítson fel. Az elsődleges vagy szekunder alkohol hozzáadása, majd a 25 szulfenát trietil-aminnal történő deprotonálása a kívánt aldehidhez vagy ketonhoz vezet.
