- a Vsmc – K plaszticitása a fiziológiában és a betegségben
- a Vsmc-K befolyásolják az Adventitia immunválaszát hiperlipidémiás egerekben
- öregedés vagy krónikus, vagy mindkettő?
- az újonnan kialakult Adventitia struktúrák részt vesznek az atlo funkcióban azáltal, hogy elősegítik a limfocita recirkulációt
- az Atlo képződés erősen Territorializált, ami azt jelzi, hogy a jelek a plakkoktól az Adventitiáig terjednek limfoid Szövetszervező-szerű VSMCs-n keresztül
- a Vsmc-k közvetlenül hozzájárulnak az Adventitia immunitáshoz atherosclerosisban
- következtetés
- szerzői hozzájárulások
- finanszírozás
- összeférhetetlenségi nyilatkozat
a Vsmc – K plaszticitása a fiziológiában és a betegségben
a vaszkuláris simaizomsejtek (Vsmc-k) a közepes és nagy méretű artériák fő alkotóelemei. Bár az aterogenezis mechanizmusait nagyrészt még meg kell határozni, tanulmányok kimutatták, hogy a betegség progressziója magában foglalja az áthallást az immunsejtek között mind az ECs-vel, mind a Vsmc-kkel. Ezen kölcsönhatások némelyike elősegíti a plakk növekedését, míg mások csökkentik az ateroszklerotikus plakkok méretét, sejtösszetételét és stabilitását (1, 2) (1.ábra, 1. táblázat). A vsmc-k figyelemre méltó plaszticitást mutatnak az érrendszeri sérülésekre, a gyulladásra és a lipoprotein felhalmozódására a betegség progressziója során a génexpresszió újraprogramozásával, valamint a proliferatív, vándorló és aktivált fenotípusra való áttéréssel, azaz a fenotípusváltással (5). Ábrán 1, olyan kritikus molekuláris kapcsolókat ábrázolunk, amelyeket a betegség progressziójának fontos szabályozóinak javasoltak (3, 6, 8, 11). Az ateroszklerózis megindítása során a vérből származó monociták, amelyeket az intima-ba toboroztak, felhalmozódnak a lipid, ami habos megjelenést kölcsönöz nekik. Ezek a habsejtek hozzájárulnak a zsírcsíkképződéshez, amely az ateroszklerotikus plakkok legkorábbi és esetleg reverzibilis stádiumát képezi. A zsíros csíkok fokozatosan atheromákká/plakkokká alakulnak, amelyek végül vsmc-ket, T-sejteket és mieloid sejteket tartalmazó kiterjesztett plakkokhoz vezetnek (1.ábra) (33). Érdekes módon az ateroszklerotikus plakk összetétele, nem pedig annak mérete határozza meg stabilitását, mivel a rostos sapka vastagsága és a nekrotikus magméret a stabil vagy az instabil plakk potenciális jellemzői (4, 9). Az intima rétegben lévő vsmc-ket hagyományosan előnyösnek tekintik az aterogenezis során, mert extracelluláris mátrix komponenseket termelnek, ezáltal elősegítve az erősebb rostos sapkák kialakulását, amelyek védelmet nyújtanak a plakk repedése ellen (4, 9). Egyre nyilvánvalóbbá válik, hogy a Vsmc-k számos strukturális és funkcionális fenotípusos átalakuláson mennek keresztül, és akár teljesen elveszíthetik natív tulajdonságaikat, hogy más sejttípusok jellemzőit szerezzék, beleértve a makrofágokat is. Az adatok azt mutatják, hogy a Vsmc-k Janus fej típusú dichotomikus fenotípusokat szerezhetnek, azaz pro – vs.anti-aterogén tulajdonságokkal, a szöveti környezettől és a kockázati tényezők hatásától függően (3). A vsmc-k citokineket szabadítanak fel, hogy stimulálják a szomszédos ECs-t adhéziós molekulák expresszálására és citokinek felszabadítására, és/vagy fokozzák a monocita/makrofágok kemotaxisát a plakkban (3, 34, 35) (1.táblázat). Ezek az adatok azt mutatják, hogy a vsmc-k felhalmozódása a rostos sapkában vagy az intima-ban előnyös, míg veszteségük vagy gyulladásos fenotípussá való átmenetük káros, és hogy a Vsmc-k proliferációja/migrációja vs.halál/öregedés határozza meg az atheroprogressziót vs. plakk stabilitás (3). A VSMC biológiájának számos további aspektusát az egészség és a betegség területén nemrégiben egy sor kiváló értékelés (https://academic.oup.com/cardiovascres/issue/114/4) fedte le, és itt nem foglalkozunk. Az alábbiakban ezért az adventitia szerepére és a Vsmc-k lehetséges hatására összpontosítunk az ATLO-formációban.

1. ábra. A vsmc-k fenotípusai az ateroszklerózis progressziója során rendkívüli plaszticitást mutatnak. Az atheroscleroticus plakkokban az ECs és a Vsmc aktivált fenotípusokat mutat (3, 4). A Vsmc-k egy része a médiából származik, miután felvették az intima-ba; más Vsmc-k lehetnek csontvelőből származók, vagy származhatnak a keringésben lévő mieloid sejtekből (mm) (3). A Vsmc-k egy része elszaporodik (töltő) (3, 5). A vsmc-k extracelluláris mátrix komponenseket választanak ki; a pluripotens transzkripciós faktor, azaz a Klf4, nagy szerepet játszhat a fenotípus-kapcsolásnak (PT) nevezett folyamatban (6, 7). Az atheroscleroticus plakk megvédésére tett kísérletek során a halálos szakadástól az Oct4 szabályozhatja a remigrációnak nevezett folyamatot, hogy rostos sapkát képezzen (4, 8-10). Az öregedés és az apoptózis további gyulladásos citokinek képződését váltja ki, hogy nekrotikus magot képezzenek, amely halálos klinikai következményekkel járó ördögi kört indít el a betegség késői szakaszában (3, 4, 11).
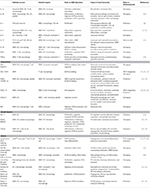
táblázat 1. A vsmc által közvetített ateroszklerózis immunitásában részt vevő legfontosabb gyulladásos mediátorok.
a Vsmc-K befolyásolják az Adventitia immunválaszát hiperlipidémiás egerekben
az elmúlt két évtizedben egyre nyilvánvalóbbá vált, hogy az adventitia egy rendkívül összetett és immunológiailag aktív szövet, amely olyan különböző sejteket hordoz, mint a stromasejtek, idegek, nyirokerek, vasa vasora és rezidens leukociták/progenitor sejtek, amelyek mindegyike képes befolyásolni a betegség előrehaladását (36, 37). Megfigyeltük, hogy az APOE−/− egerek adventitia jelentős szerkezetátalakítási eseményeken megy keresztül az atherosclerosis minden szakaszában: Mind a veleszületett, mind az adaptív immunsejtek felhalmozódnak a szomszédos ateroszklerotikus plakkok mellett (2.ábra). Sőt, kísérleti egereken végzett vizsgálatainkat megerősítették az emberi beteg artériákban: mi és mások ATLO-szerű struktúrákat figyeltünk meg az atheroscleroticus aorta aneurizmában szenvedő betegek adventitiájában (38, 39) és újabban Akhavanpoor et al. megfigyelt jól fejlett ATLOs az ischaemiás szívbetegségben szenvedő betegek jelentős százalékának adventitiájában (40). Egér atherosclerosisban a nyirokér -, a magas endothelialis venule (HEV) – és az erek neogenezise kiemelkedő jellemzői ennek a szerkezetátalakítási folyamatnak (16, 41).
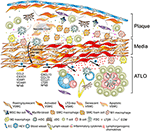
2. ábra. Az érrendszeri simaizomsejtek (VSMC) részt vesznek az adventitia immunitásában a plakkképződés során. Az atheroscleroticus plakkok és az adventitia közé szorított vsmc-k limfoid szövetszervező-szerű fenotípust fogadnak el a plakkból származó jelzéseken keresztül történő aktiválás után (Anna), majd transzdifferenciálódnak LTo-szerű sejtekké (RV). Proliferatív és citokint expresszáló fenotípusuk révén befolyásolják az adventitia szerkezetátalakítását és szobrászatát, beleértve az angiogenezist, a HEV-képződést és a nyirokerek neogenezisét (perv). A fenotípus-váltás a lymphorganogén kemokinek, azaz a CXCL13 és a CCL21 expresszióját és szekrécióját is eredményezi, ezáltal elősegítve a grafikon alsó részén vázlatosan ábrázolt ATLO képződést.
öregedés vagy krónikus, vagy mindkettő?
fontos megállapítást nyert, hogy az öregedés az adventitia szerkezetátalakításának és szobrászatának fő meghatározója. Teljesen fejlett ATLOs alakul ki az ateroszklerózis előrehaladott stádiumaiban, de korai stádiumuk, azaz a T / B sejt aggregátumok az ateroszklerotikus plakkok kialakulásával párhuzamosan jelennek meg (16, 27, 41, 42). Valójában ezek a korai ATLOs-ok ~30 hetes korban alakulnak ki, és körülbelül 52 hét múlva érik el a fejlettebb szakaszokat, hogy a csúcsot 78 héten érjék el (16, 41). A TLO-k hasonló életkorfüggő fejlődési stádiumait figyelték meg más krónikus, nem oldható betegségekben (1, 42). Ezek az adatok azt mutatják, hogy az ATLO fejlődése korfüggő, az öregedés pedig pozitívan kapcsolódik az adventitiális szobrászathoz (2.ábra). Az öregedés és a krónikusság közötti összefüggést azonban nehéz tanulmányozni egér atherosclerosisban, mivel az ateroszklerotikus plakk kialakulása az aortaívben kezdődik, majd az aortát elvetve eljut a hasi aortába a betegség későbbi szakaszaiban, így hosszabb ideig tart. További munkára van szükség annak tisztázásához, hogy az immunsejtek és / vagy a VSMC öregedése hozzájárul-e az ATLO kialakulásához, és hogy mely sejttípusok, pl., VSMCs, ECS és / vagy immunsejtek vesznek részt. A TLO-képződés más formáinak, például a tüdőben és a gyomor-bél traktusban előforduló tanulmányai azt mutatják, hogy az immunrendszer jóhiszemű öregedési eseményei helyett a tartós gyulladásos szöveti reakció krónikussága döntően hozzájárul az ATLOs kialakulásához (43, 44).
az újonnan kialakult Adventitia struktúrák részt vesznek az atlo funkcióban azáltal, hogy elősegítik a limfocita recirkulációt
a fejlett ATLO szakaszok közé tartoznak a T/B sejt aggregátumok, az aktivált B-sejt tüszők csíraközpontjai, a nyirokerek, a T-sejt területeken lévő HEV-k és az extracelluláris vezetékhálók (16). Ezek a jelentős változások hasonlítanak a másodlagos limfoid szervekben található struktúrákra, ahol elősegítik az antigénre adott immunválasz alapvető szempontjait, beleértve a Na-K recirkulációját is. a limfociták, hogy megtalálják kognitív antigénjeiket / autoantigénjeiket, valamint a B-sejtek affinitás érésének megszervezése a potenciális autoantigének felé. Örökbefogadó limfocita transzfervizsgálatok alkalmazásával megfigyeltük, hogy az ATLOs nagymértékben fokozza a limfociták toborzását az artériás falba mind a bevándorlás, mind az antigén-tapasztalatlan limfociták kivándorlásának egyidejű enyhítésével (27). Toborzásuk után a T-sejtek aktiválódnak, szaporodni kezdenek, és a CD4 T-helper sejtek egy része indukált t-szabályozó sejtekké alakul át. Ezek az adatok azt mutatják, hogy az adventitia immunrendszere nagyon érzékeny az artériás fal mögöttes gyulladásos szöveti reakciójára. Ezenkívül úgy tűnik, hogy az aktivált B-sejt tüszőkben csíraközpontokat képező B-sejtek csíraközpont-reakción mennek keresztül follikuláris dendritikus sejtek jelenlétében, ahol egyesek memória B-sejtekké alakulnak át, míg mások elhagyják a csíraközpontokat, hogy plazmasejtekké váljanak (45). Ezek az adatok együttesen azt mutatják, hogy az ATLOs, nem pedig a másodlagos limfoid szervek (amint azt korábban gondoltuk) az ateroszklerózis immunitását szervezik.
az Atlo képződés erősen Territorializált, ami azt jelzi, hogy a jelek a plakkoktól az Adventitiáig terjednek limfoid Szövetszervező-szerű VSMCs-n keresztül
az adventitia szerkezetátalakításának másik aspektusa az aterogenezis során az ATLO képződés erősen territorializált, nagyrészt az adventitia szegmensekre korlátozódik atheroscleroticus plakkok a hasi aortában egerekben (16, 45). Az ATLOs-t csak alkalmanként találják meg az innominate artéria vagy az aortaív adventitiájában, ahol az atherosclerosis a legjelentősebb. Az aorta mellkasi szegmenseiben lévő immunsejtek főleg T-sejt aggregátumokból állnak, szemben a hasi aorta ATLOs-jával (16, 41). Az ATLOs képződésének pontos mechanizmusa a hasi aortában még nem ismert. Úgy tűnik, hogy a TLO-k számos krónikus, nem oldható gyulladásos betegség jellemzője, és az autoimmun betegségek kiemelkedő jellemzői (42). Az atherosclerosisban a TLO-k cellularitása és szerkezete hasonló a TLO-khoz sok más krónikus betegségben, beleértve a rákkal összefüggő TLO-képződést (46, 47). A TLO biológia területe drámai módon bővült az elmúlt években, felvetve annak fontos lehetőségét, hogy az új terápiás cél azonosítható a TLO funkciójának megértésével az egyes TLO-társuló betegségekben. A TLO-k különféle típusai azonban felfednek néhány betegség-specifikus tulajdonságot, amelyek végső soron meghatározhatják, hogy a kapcsolódó immunválaszok károsak vagy védőek-e. Az ilyen betegségspecifikus jellemzők számos mechanizmus egyikén keresztül keletkezhetnek, beleértve a szervspecificitást és a szövetkárosodás jellegét (1, 42). A limfoid szervek fejlődése összetett folyamat, amely magában foglalja a hematopoietikus lymphoid tissue inducer (LTi) sejteket, a nem hematopoietikus stromális lymphoid tissue organizer (LTo) sejteket és az LT Xhamr jelátvitelt. Az egér aorta Vsmc-K in vitro vizsgálata azt mutatta, hogy megfelelő stimuláció esetén LTo-szerű sejtekként szolgálhatnak (20), amelyeket eredetileg az embrionális fejlődés során azonosítottak a másodlagos limfoid szövetek kialakulása során, beleértve a nyirokcsomókat és a lépet (48, 49) (lásd alább). Fontos megjegyezni, hogy úgy tűnik, hogy az ATLOs fontos résztvevőként vonja be a Vsmc-ket, míg más TLO-k más LTo-szerű mezenchimális sejteket tartalmaznak (50). A TLO-k minden formájának közös nevezője azonban–a másodlagos limfoid szervektől eltérően-krónikus gyulladásos szöveti reakció, amely az immunrendszert arra készteti, hogy ezeket a limfoid struktúrákat a beteg szövet közelében vagy bizonyos esetekben belül alakítsa ki (42, 43).
a Vsmc-k közvetlenül hozzájárulnak az Adventitia immunitáshoz atherosclerosisban
tekintettel az atheroscleroticus plakkokkal szomszédos ATLOs erősen territorializált jellegére, úgy érveltünk, hogy a Vsmc-k részt vehetnek az ATLO kialakulásában, és ugyanezen okból funkcionális szerepet játszhatnak az atherosclerosis progressziójában. A vsmc – k erősen expresszálják az LT-t konstitutív módon (16), míg annak liganduma Lta1 ++ 2 különféle immunsejteken expresszálódik, amelyeket LTi-sejteknek neveznek (51). Feltételezik, hogy a vsmc-k az LT-n keresztül aktiválódnak az LTI jelátviteli útvonalon a szekunder limfoid szövet neogenezisében részt vevő lti sejtek. Az LTi sejt eredetét még nem határozták meg egyértelműen, bár az aktivált makrofágok és az intima plakk más immunsejtjei jelöltek erre a tevékenységre az LTO neogenezisében. A sejtes és oldható mediátorokra adott válaszként úgy tűnik, hogy a vsmc-k a lymphorganogén kemokinek parakrin-szekréciója, azaz a CXCL13 és a CCL21 paracrin-szerű fenotípusra váltanak, ezáltal immunsejteket, például makrofágokat/dendritikus sejteket, T-sejteket és B-sejteket vonzanak a helyi adventitia miliőbe, ami ATLO kialakulásához vezet az adventitia-ban (27, 41, 45) (1.táblázat). Globális vagy VSMC-specifikus lt-specifikus hiány az idős hiperlipidémiás ApoE – / – egerekben fokozott atheroscleroticus plakkképződést mutatott, jelezve, hogy a VSMC lt Xhamr képes csillapítani az atherosclerosis kialakulását bizonyos kísérleti körülmények között (27). Más tanulmányok azonban azt mutatták, hogy a magas zsírtartalmú étrendben (HFD) tartott fiatal globális ApoE−/− LTbR−/−egerek alacsonyabb aorta plakkterhelést mutattak ki, mint normál étrenddel táplált ApoE-/− társaik (52). Ezek a látszólagos ellentmondó adatok azt mutatják, hogy az LT-ok szerepe fiatal egerekben és túlzott hiperlipidémia esetén eltérő lehet a két modellben. Alternatív megoldásként a magas zsírtartalmú étrend, amely drámai és esetleg mámorító plazma lipidszinthez vezet, felelős lehet ezekért a különbségekért. Mivel nem használunk rendszeresen magas zsírtartalmú étrendet ApoE – / – egerekben, ezek az eltérések megoldatlan kérdések maradnak, bár kimutatták, hogy az immunrendszert túlterhelhetik a plazma lipidek szélsőséges szintje . Ezek az adatok további vizsgálatokat igényelnek, hogy megvizsgálják az LT-ok látszólagos dichotómiájának molekuláris alapját az atherosclerosis progressziójában fiatal vs. idős egerek és / vagy korai vs.előrehaladott ateroszklerózis. Ezenkívül a csontvelőből származó makrofágok lt-Incentrumfüggetlen LTi sejtekként működhetnek, és kiválthatják a CCL19, CCL20 és CXCL16 expresszióját a VSMCs által (53) (1.táblázat). Így a Vsmc-k részt vehetnek a TLO-k kialakulásában atherosclerosisban a limforganogén kemokinek felszabályozásával, hogy elősegítsék az immunsejt-aggregátumokat az adventitia-ban. Mint fentebb említettük, az ATLOs gyakori az ischaemiás szívkoszorúér-betegség (40) és az emberi ateroszklerotikus aorta aneurysmákban (38, 39). Ha együtt vesszük, az ATLOs előfordulása kísérleti egerekben és humán ateroszklerózisban fontos kérdéseket vet fel az ateroszklerózis mint autoimmun betegség természetével kapcsolatban: elképzelhető, hogy az aterogenezis során autoimmun T-sejtek és autoimmun B-sejtek keletkeznek, amelyek még nem azonosítottak autoantigének ellen irányulnak. Az ilyen autoimmun limfociták izolálása, beleértve a T-sejt receptorok és/vagy B-sejt receptorok szekvenálását, lehetővé tenné az atherosclerosis főbb hipotéziseinek tesztelését. Valójában az atherosclerosis kutatása jelentős változáson megy keresztül, és lehetővé válik az egyes autoimmun limfocita klónok tesztelése funkcionális in vitro és in vivo rendszerekben.
következtetés
az Atherosclerosis az artériák gyulladásos betegsége. A vsmc-k kommunikálnak mind az ECs-vel, mind az ateroszklerotikus plakkok immunsejtjeivel, valamint az adventitia rezidens sejtjeivel. Ez a képesség lehetővé teszi a Vsmc-k számára, hogy jelentős módon befolyásolják az ateroszklerózis immunitását, beleértve az ATLOs kialakulását. További munkára van szükség a Vsmc-k szerepének körvonalazásához az atherosclerosis különböző szakaszaiban, meghatározzák szerepüket a fiatal vs. öregedő artériákban, és tovább tisztázzák dichotomikus szerepüket a betegség progressziójában. Ezeknek a folyamatoknak a jobb megértése megnyithatja az utat a terápiás stratégiák kidolgozásához a jövőbeni beavatkozáshoz a betegség klinikailag fontos késői stádiumaiban.
szerzői hozzájárulások
minden szerző hozzájárult a benyújtott kézirat tervezéséhez, írásához és szerkesztéséhez, és jóváhagyta a közzétételt.
finanszírozás
összeférhetetlenségi nyilatkozat
a szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.
4. Clarke MC, Figg N, Maguire JJ, Davenport AP, Goddard M, Littlewood TD és mtsai. Az érrendszeri simaizomsejtek apoptózisa a plakk sebezhetőségének jellemzőit idézi elő az ateroszklerózisban. Nat Med. (2006) 12:1075–80. doi: 10.1038 / nm1459
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
5. Owens GK, Kumar MS, Wamhoff BR. A vaszkuláris simaizomsejtek differenciálódásának molekuláris szabályozása a fejlődésben és a betegségben. Physiol Rev. (2004) 84:767-801. doi: 10.1152 / physrev.00041.2003
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Scholar
6. Shankman LS, Gomez D, Cherepanova OA, lazac M, Alencar GF, Haskins RM, et al. A simaizomsejtek klf4-függő fenotípusos modulációja kulcsszerepet játszik az ateroszklerotikus plakk patogenezisében. Nat Med. (2015) 21:628–37. doi: 10,1038 / nm.3866
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Tudós
7. Gomez D, Owens GK. Sima izomsejt fenotípusos váltás atherosclerosisban. Cardiovasc Res. (2012) 95:156-64. doi: 10.1093/cvr / cvs115
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
8. Cherepanova OA, Gomez D, Shankman LS, Swiatlowska P, Williams J, Sarmento OF, et al. Az OCT4 PLURIPOTENCIA faktor aktiválása a simaizomsejtekben atheroprotektív. Nat Med. (2016) 22:657–65. doi: 10,1038 / nm.4109
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Tudós
10. Yla-Herttuala S, Bentzon JF, Daemen M, Falk E, Garcia-Garcia HM, Herrmann J, et al. Az ateroszklerotikus plakkok stabilizálása. Az Európai Kardiológiai Társaság (ESC) atherosclerosis és érbiológia munkacsoportjának állásfoglalása. Thromb Haemost. (2011) 106:1–19. doi: 10, 1160 / TH10-12-0784
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
11. Grootaert MOJ, Moulis M, Roth L, Martinet W, Vindis C, Bennett MR és mtsai. Vaszkuláris simaizomsejtek halála, autofágia és öregedés atherosclerosisban. Cardiovasc Res. (2018) 114:622-34. doi: 10.1093/cvr / cvy007
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
14. Akhavanpoor M, Akhavanpoor H, Gleissner CA, Wangler S, doch AO, Katus HA, et al. Az Interleukin-17A két arca atherosclerosisban. Curr Drog Célpontok. (2017) 18:863–73. doi: 10.2174/1389450117666161229142155
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
15. Jia G, Cheng G, Gangahar DM, Agrawal DK. Az inzulinszerű növekedési faktor-1 és a TNF-alfa szabályozza az autofágiát a C-jun N-terminális kináz és az Akt útvonalakon keresztül humán ateroszklerotikus vascularis simasejtekben. Immunol Sejt Biol. (2006) 84:448–54. doi: 10.1111 / j. 1440-1711.2006. 01454.x
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
16. Grabner R, Lotzer K, Dopping S, Hildner M, Radke D, Beer M, et al. A limfotoxin béta receptor jelátvitel elősegíti a tercier limfoid organogenezist az idős ApoE – / – egerek aorta adventitiájában. J Exp Med. (2009) 206:233–48. doi: 10.1084 / jem.20080752
CrossRef Teljes Szöveg / Google Scholar
17. Damas JK, Smith C, Oie-E, Fevang B, Halvorsen B, Waehre T, et al. A ccl19 és CCL21 homeosztatikus kemokinek fokozott expressziója klinikai és kísérleti atherosclerosisban: lehetséges patogén szerep a plakk destabilizációban. Arterioscler Thromb Vasc Biol. (2007) 27:614–20. doi: 10.1161 / 01.ATV.0000255581.38523.7c
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Doring Y, Noels H, van der Vorst EPC, Neideck C, Egea V, Drechsler M, et al. Vascular CXCR4 limits atherosclerosis by maintaining arterial integrity: evidence from mouse and human studies. Circulation. (2017) 136:388–403. doi: 10.1161/CIRCULATIONAHA.117.027646
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Akhtar S, Gremse F, Kiessling F, Weber C, Schober A. CXCL12 promotes the stabilization of atherosclerotic lesions mediated by smooth muscle progenitor cells in Apoe-deficient mice. Arterioscler Thromb Vasc Biol. (2013) 33:679–86. doi: 10.1161/ATVBAHA.112.301162
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Lotzer K, Dopping S, Connert S, Grabner R, Spanbroek R, Lemser B, et al. Mouse aorta smooth muscle cells differentiate into lymphoid tissue organizer-like cells on combined tumor necrosis factor receptor-1/lymphotoxin beta-receptor NF-kappaB signaling. Arterioscler Thromb Vasc Biol. (2010) 30:395–402. doi: 10.1161 / ATVBAHA.109.191395
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Scholar
21. E. M., E. M., E. M., E. M., E. M., E. M., M. M., M. M., M. M., M. M., M. M., M. M., M. M., M. M., M. M., M. M. A homeosztatikus kemokin cxcl13 fokozott szintje humán ateroszklerózisban-potenciális szerep a plakk stabilizálásában. Atherosclerosis. (2012) 224:266–73. doi: 10.1016 / j.érelmeszesedés.2012.06.071
CrossRef Teljes Szöveg / Google Scholar
22. Higashi Y, Sukhanov S, Shai SY, Danchuk S, Tang R, Snarski P, et al. Az inzulinszerű növekedési faktor-1 receptor hiánya a makrofágokban felgyorsítja az érelmeszesedést és instabil plakk fenotípust indukál az apolipoprotein E-hiányos egerekben. Keringés. (2016) 133:2263–78. doi: 10.1161/CIRCULATIONAHA.116.021805
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Tudós
23. Alexander Úr, Owens GK. A simaizomsejtek differenciálódásának epigenetikus szabályozása és fenotípusos váltás az érfejlődésben és a betegségben. Annu Rev Physiol. (2012) 74:13–40. doi: 10.1146 / annurev-physiol-012110-142315
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
24. Ő C, vegyes SC, Hu T, Hinsdale ME, Lupu F, Virmani R, et al. A PDGFRbeta jelátvitel szabályozza a helyi gyulladást és szinergizál a hypercholesterinaemiával az ateroszklerózis elősegítése érdekében. Nat Commun. (2015) 6:7770. doi: 10.1038 / ncomms8770
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
26. Da Ros F, Carnevale R, Cifelli G, Bizzotto D, Casaburo M, Perrotta M és mtsai. Az Interleukin-1beta célzása megvédi a zavart transzformáló növekedési faktor béta jelátvitel által kiváltott aorta aneurizmákat. Mentesség. (2017) 47: 959-73 e9. doi: 10.1016 / j.immuni.2017.10.016
CrossRef Teljes Szöveg / Google Scholar
27. Hu D, Mohanta SK, Yin C, Peng L, Ma Z, Srikakulapu P, et al. Az arteria tercier limfoid szervek szabályozzák az aorta immunitását és védik az érelmeszesedést a vaszkuláris simaizomsejt limfotoxin béta receptorokon keresztül. Mentesség. (2015) 42:1100–15. doi: 10.1016 / j.immuni.2015.05.015
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Scholar
29. Paramel Varghese G, Folkersen L, Strawbridge RJ, Halvorsen B, Yndestad Egy, Ranheim T, et al. NLRP3 gyulladásos expresszió és aktiváció humán atherosclerosisban. J Am Szív Assoc. (2016) 5:e003031. doi: 10.1161 / JAHA.115.003031
CrossRef Teljes Szöveg / Google Scholar
30. de Jong RJ, Paulin N, Lemnitzer P, ifjabb Viola, téli C, Ferraro B, et al. Az A1 annexin védő alkalmassága artériás neointima képződésben atherosclerosisra hajlamos egerekben-rövid jelentés. Arterioscler Thromb Vasc Biol. (2017) 37:312–5. doi: 10.1161 / ATVBAHA.116.308744
CrossRef Teljes Szöveg / Google Scholar
32. van Gils JM, Derby MC, Fernandes LR, Ramkhelawon B, Ray TD, Rayner KJ és mtsai. A neuroimmune guidance cue netrin-1 elősegíti az ateroszklerózist azáltal, hogy gátolja a makrofágok kivándorlását a plakkokból. Nat Immunol. (2012) 13:136–43. doi: 10.1038 / ni.2205
CrossRef Teljes Szöveg / Google Scholar
35. Tchkonia T, Zhu Y, van Deursen J, Campisi J, Kirkland JL. A sejtek öregedése és az öregedő szekréciós fenotípus: terápiás lehetőségek. J Clin Invest. (2013) 123:966–72. doi: 10.1172 / JCI64098
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
37. Majesky MW, Horita H, Ostriker A, Lu S, Regan JN, Bagchi A, et al. A differenciált simaizomsejtek a rezidens vaszkuláris progenitor sejtek szubpopulációját generálják a klf4 által szabályozott adventitia-ban. Circ Res. (2017) 120: 296-311. doi: 10.1161 / CIRCRESAHA.116.309322
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Tudós
40. Akhavanpoor M, Gleissner CA, Akhavanpoor H, Lasitschka F, Doesch AO, Katus HA, et al. Adventitialis tercier limfoid szerv osztályozás emberi ateroszklerózisban. Cardiovasc Pathol. (2018) 32:8–14. doi: 10.1016 / j. carpath.2017.08.002
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Scholar
41. Moos képviselő, John N, Grabner R, Nossmann S, Gunther B, Vollandt R, et al. A lamina adventitia az immunsejtek felhalmozódásának fő helye a standard chow-val táplált apolipoprotein E-hiányos egerekben. Arterioscler Thromb Vasc Biol. (2005) 25:2386–91. doi: 10.1161 / 01.ATV.0000187470.31662.fe
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
42. Mohanta SK, Yin C, Peng L, Srikakulapu P, Bontha V, Hu D, et al. Az arteria tercier limfoid szervek hozzájárulnak a veleszületett és adaptív immunválaszokhoz az előrehaladott egér atherosclerosisban. Circ Res. (2014) 114: 1772-87. doi: 10.1161 / CIRCRESAHA.114.301137
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Tudós
43. Buettner M, Lochner M. a másodlagos és tercier limfoid szervek fejlődése és működése a vékonybélben és a vastagbélben. Első Immunol. (2016) 7:342. doi: 10.3389 / fimmu.2016.00342
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Scholar
45. Srikakulapu P, Hu D, Yin C, Mohanta SK, Bontha SV, Peng L, et al. Az artéria tercier limfoid szervei szabályozzák a többrétegű territorializált atherosclerosis B-sejt válaszokat idős ApoE – / – egerekben. Arterioscler Thromb Vasc Biol. (2016) 36:1174–85. doi: 10.1161 / ATVBAHA.115.306983
CrossRef Teljes Szöveg / Google Scholar
48. van de Pavert SA, Mebius RE. Új betekintés a limfoid szövetek fejlődésébe. Nat Rev Immunol. (2010) 10:664–74. doi: 10.1038 | nri2832
CrossRef teljes szöveg / Google Tudós
50. Barone F, Gardner DH, Nayar S, Steinthal N, Buckley CD, Luther SA. Stromális fibroblasztok tercier limfoid struktúrákban: új célpont krónikus gyulladásban. Első Immunol. (2016) 7:477. doi: 10.3389 / fimmu.2016.00477
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Tudós
51. Scandella E, Bolinger B, Lattmann e, Miller s, Favre S, Littman dr. és mtsai. A limfoid szerv integritásának helyreállítása a limfoid szövet-induktor sejtek kölcsönhatása révén a T-sejt zóna sztrómájával. Nat Immunol. (2008) 9:667–75. doi: 10.1038 / ni.1605
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Tudós
52. Nagy M, Feldmann K, GOTHERT JR, Dick LS, Homann S, Klatt C, et al. Deficiency in lymphotoxin beta receptor protects from atherosclerosis in apoE-deficient mice. Circ Res. (2015) 116:e57–68. doi: 10.1161/CIRCRESAHA.116.305723
PubMed Abstract | CrossRef Full Text | Google Scholar
53. Guedj K, Khallou-Laschet J, Clement M, Morvan M, Gaston AT, Fornasa G, et al. M1 macrophages act as LTbetaR-independent lymphoid tissue inducer cells during atherosclerosis-related lymphoid neogenesis. Cardiovascular research. (2014) 101:434–43. doi: 10.1093/cvr/cvt263
PubMed Abstract | CrossRef Full Text | Google Scholar