26. október 2020, az NCI munkatársai
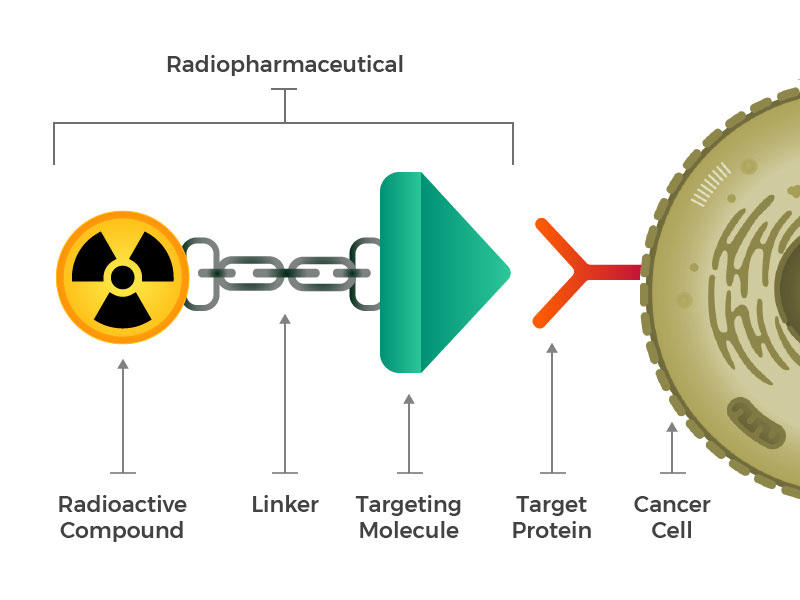
a radiofarmakonok egy radioaktív molekulából, egy célzómolekulából és egy összekapcsoló molekulából állnak.
az elmúlt két évtized tengeri változást hozott a rák számos típusának kezelésében. A célzott terápiák leállítják a rákos sejtekben lévő specifikus fehérjéket, amelyek segítenek nekik növekedni, osztódni és terjedni. Az immunterápiák stimulálják vagy elnyomják a szervezet immunrendszerét a rák elleni küzdelem érdekében. De a régóta alkalmazott kezelések-a műtét, a kemoterápia és a sugárterápia — továbbra is a legtöbb rák kezelésének gerincét képezik.
a sugárterápiát először több mint 100 évvel ezelőtt alkalmazták a rák kezelésére. A rákos betegek körülbelül fele még mindig megkapja azt a kezelés során. Egészen a közelmúltig a legtöbb sugárterápiát ugyanúgy alkalmazták, mint 100 évvel ezelőtt, a testen kívüli sugárzási sugarak sugárzásával, hogy elpusztítsák a testben lévő daganatokat.
bár hatékony, a külső sugárzás járulékos károkat is okozhat. Még a modern sugárterápiás berendezésekkel is” normális szövetre van szükség ahhoz, hogy egy daganathoz jusson ” – mondta Charles Kunos, Ph.D., az NCI Cancer Therapy Evaluation Program (CTEP). A sugárterápia mellékhatásai a kezelt test területétől függenek, de magukban foglalhatják az ízvesztést, a bőrváltozásokat, a hajhullást, a hasmenést és a szexuális problémákat.
most a kutatók egy új gyógyszercsoportot fejlesztenek ki, az úgynevezett radiofarmakonokat, amelyek közvetlenül és kifejezetten a rákos sejtekhez juttatják a sugárterápiát. Az elmúlt néhány évben robbanásszerűen terjedtek az új radiofarmakonokat vizsgáló kutatások és klinikai vizsgálatok.
ezek a tanulmányok azt sugallták, hogy a sugárterápia sejtszintű célzása csökkentheti a kezelés rövid és hosszú távú mellékhatásainak kockázatát, ugyanakkor lehetővé teszi a rákos sejtek apró lerakódásainak elpusztítását az egész testben.
“úgy gondolom, hogy a következő 10-15 évben átalakítják a sugárzás onkológiáját” – mondta Dr. Kunos.
természetes affinitásra építve
a sugárzás közvetlenül a sejtekbe juttatása önmagában nem új megközelítés. Az egyik ilyen terápiát, az úgynevezett radioaktív jódot az 1940-es évek óta alkalmazzák a pajzsmirigyrák bizonyos típusainak kezelésére. a jód természetesen felhalmozódik a pajzsmirigy sejtjeiben. Az elem radioaktív változata előállítható a laboratóriumban. Lenyelve (tabletta vagy folyadék formájában) felhalmozódik és megöli a pajzsmirigy műtét után megmaradt rákos sejteket.
később hasonló természetes affinitást alkalmaztak a csontokba terjedő rák kezelésére szolgáló gyógyszerek kifejlesztésére, mint például a rádium 223-diklorid (Xofigo), amelyet 2013-ban hagytak jóvá metasztatikus prosztatarák kezelésére. Amikor a rákos sejtek növekednek a csontban, az általuk behatolt csontszövet lebontását okozzák. A test ezután megpróbálja kijavítani ezt a károsodást a csont cseréjével-ezt a folyamatot csontforgalomnak nevezik.
a rádium radioaktív elem “úgy néz ki, mint egy kalciummolekula, tehát beépül a test olyan területeibe, ahol a csontforgalom a legnagyobb”, például olyan területekre, ahol a rák növekszik, magyarázta Dr. Kunos. A rádium ezután képes megölni a közeli rákos sejteket.
ezek a radioaktív vegyületek minden segítség nélkül eljutnak a rákos sejtekbe. A kutatók azon tűnődtek, vajon lehetséges-e új radioaktív molekulákat tervezni, amelyek kifejezetten más rákokat céloznak meg.
olyan mesterséges radiofarmakonokat képzeltek el, amelyek három fő építőelemből állnak: egy radioaktív molekulából, egy célzómolekulából (amely felismeri és rögzíti a rákos sejteket), és egy összekapcsoló molekulából, amely összeköti a kettőt. Az ilyen vegyületeket be lehet injektálni, infundálni, belélegezni vagy bevenni, majd bejuthatnak a véráramba.
az a gondolat, hogy egy rákot célzó molekulát összekapcsoljanak egy olyan molekulával, amely megöli a rákos sejteket, szintén nem új. Például számos antitest–gyógyszer konjugátumnak nevezett gyógyszert engedélyeztek a rák kezelésére, amelyekben egy specifikus rákos sejtekhez kötődő antitest toxikus gyógyszerhez kapcsolódik.
de az ilyen gyógyszerek létrehozására irányuló erőfeszítések korlátozott sikerrel jártak, Dr. Kunos elmagyarázta, mert nem elég, hogy a toxinokat a rákos sejtekhez közel hozzák. A toxinokat be kell venni, és elég hosszú ideig a sejtekben kell maradniuk ahhoz, hogy kárt okozzanak. Sok rákos sejt rendelkezik vagy fejleszt olyan mechanizmusokat, amelyek egyszerűen visszaszivattyúzzák a toxinokat, mielőtt ez megtörténhet.
a radiofarmakonok akkor működnek a legjobban, ha a gyógyszerek bejuthatnak a sejtekbe. De ez nem szükséges ahhoz, hogy hatékonyak legyenek. Miután egy radiofarmakon beragadt egy rákos sejtbe, a radioaktív vegyület természetesen lebomlik. Ez a bomlás olyan energiát szabadít fel, amely károsítja a közeli sejtek DNS-ét. És amikor egy sejt DNS-e helyrehozhatatlanul károsodik, az a sejt meghal. A rákos sejtek különösen érzékenyek a sugárzás által kiváltott DNS-károsodásra.
az alkalmazott radioaktív vegyület típusától függően a keletkező energia behatolhat a radioaktív gyógyszerhez kötött sejtbe, valamint az azt körülvevő körülbelül 10-30 sejtbe. Ez növeli a rákos sejtek számát, amelyek egyetlen radiofarmakon molekulával elpusztíthatók.
a 2010-es évek közepére az Food and Drug Administration (FDA) két radiofarmakont hagyott jóvá, amelyek bizonyos B-sejtek molekuláit célozzák meg, hogy néhány embert kezeljenek non-Hodgkin limfóma, egyfajta vérrák. De ezeket a gyógyszereket soha nem fogadták el széles körben. Kevés lymphomában szenvedő beteget kezelő orvos képzett az ilyen típusú radioaktív vegyületek beadására. A radiofarmakonok pedig az újabb, nem radioaktív gyógyszerek versenyével szembesültek.
a játékváltó a területen 2018-ban jött létre, mondta Jacek Capala, Ph.D., az NCI sugárzási kutatási programjából, amikor az FDA jóváhagyta a lutécium Lu 177-dotatátot (Lutathera) bizonyos rákos neuroendokrin daganatok (NETs) kezelésére, amelyek befolyásolják az emésztőrendszert.
“ez azt mutatta, hogy a szilárd daganatokat is ilyen módon lehet megcélozni” – mondta a semmiből épített radiofarmakon. Ebben az esetben a célpontok bizonyos hormonreceptorok, amelyek bőségesen megtalálhatók a nettó sejtek felületén.
A Lutetium Lu 177-dotatate jobban lassította a nettó növekedést, mint bármely korábbi tesztelt gyógyszer, magyarázta Aman Chauhan, a Kentucky Egyetem, aki számos új klinikai vizsgálatot vezet a gyógyszerről. “Ez hatalmas előrelépés volt a területünk számára” – mondta.
a képalkotó vegyületekből származó gyógyszerek adaptálása
A kutatók most radiofarmakonokat terveznek és tesztelnek olyan különböző rákos megbetegedések számára, mint a melanoma, a tüdőrák, a vastagbélrák és a leukémia, mondta Dr. Capala. Minden olyan daganatot, amelynek sejtjeinek felszínén célzott molekula van, és jó vérellátása—elegendő a gyógyszerek szállításához—potenciálisan radiofarmakonokkal lehet kezelni, tette hozzá Dr. Chauhan.
ezen újabb gyógyszerek közül sok a nukleáris képalkotáshoz használt meglévő vegyületek újratervezett változata. A nukleáris képalkotó vizsgálatok, mint például a pozitron emissziós tomográfia (PET), néha gyengén radioaktív vegyületeket használnak, amelyek olyan molekulákhoz kapcsolódnak, amelyek a rákos sejtek felszínén specifikus célpontokhoz kötődnek. A Speciális kamerák ezután még a rákos sejtek apró lerakódásait is feltárhatják, segítve a rák terjedését a testben.
A kutatók most újra felhasználták ezeket a célmolekulákat, hogy erősebb radioaktív vegyületeket vagy izotópokat hordozzanak—olyanokat, amelyek elpusztíthatják a rákos sejteket, ahelyett, hogy egyszerűen segítenék vizualizálni őket.
a prosztatarák korai tesztelési terepe volt ennek az újrafelhasználásnak. A PSMA nevű fehérje nagy mennyiségben—és szinte kizárólag—a prosztata sejtjein található. A PSMA-hoz kötődő molekula pet-képalkotásban használt radioaktív vegyülettel történő összeolvasztásával a tudósok képesek voltak vizualizálni a prosztatarák apró lerakódásait, amelyek túl kicsiek ahhoz, hogy a hagyományos képalkotással kimutathatók legyenek.
számos, a PSMA-t megcélzó radiofarmakon kezelést most klinikai vizsgálatokban tesztelnek.
A legtöbb prosztatarák nagyon érzékeny a sugárzásra, és a külső sugárzást általában a betegség kezelésére használják, magyarázta Frank Lin, az NCI Rákkutató Központjának, aki egy PSMA-t célzó radiofarmakon klinikai vizsgálatát vezeti az NIH Klinikai Központban.
A legtöbb férfi, aki kezdeti kezelésként sugárkezelést kap, nem fogja tapasztalni a rák megismétlődését. De ha igen, akkor néha az egész testben elterjed, sok szervben sok kis rákos sejt lerakódik-magyarázta.
“amikor a daganat így terjed, akkor már nem igazán lehet külső sugárzást végezni, mert a külső sugárzást egyszerre csak a test egy kis részére lehet összpontosítani és kezelni” – mondta Dr. Lin.
A PSMA-t megcélzó radiofarmakon jobb módja a sugárzás adásának ezekben az esetekben, mivel közvetlenül a véráramba infundálható és széles körben keringhet, a prosztatarák sejtjeihez kapcsolódva, amelyek az egész testben elterjedtek-magyarázta.
és a képalkotó és kezelési molekulák nagy előnye, hogy ugyanazt a célt használják, hogy a képalkotás lehetővé teszi az orvosok számára, hogy bepillantást nyerjenek arra, hogy a kezelés valószínűleg működik-e, tette hozzá Dr. Lin.
például Dr. Lin kísérletében a férfiaknak a kezelés előtt PET-vizsgálatot kell végezniük a vegyület képalkotó változatával. Ha a képalkotó vegyület utat talál a rákos sejtekhez, és a PET-vizsgálat során kimutatható, akkor a kutatók feltételezhetik, hogy a megfelelő radiofarmakon kezelés eléri a célját.
“a diagnosztika kiegészítő fejlesztése a gyógyszeres terápiákkal együtt sokkal izgalmasabbá teszi ezt a területet” – mondta Dr. Chauhan. “Így tudjuk, hogy a terápiát közvetlenül a tumorsejtekhez szállítjuk.”
áttérés a kombinációs terápiákra
míg a radiofarmakonok ígéretesnek bizonyultak a korai vizsgálatokban, ők is, mint más típusú rákgyógyszerek esetében, valószínűleg nem pusztítják el a daganatot önmagukban.
például a lutécium Lu 177-dotatate több mint kétszeresére növelte azoknak az embereknek a számát, akiknél a neuroendokrin daganatok a kezelés után zsugorodtak, de ez a szám még mindig szerény volt: körülbelül 17%, a gyógyszer nélküli 7% – ról, magyarázta Dr. Chauhan.
“még mindig jelentős fejlesztési lehetőség van” – mondta.
radiofarmakonok használata más terápiákkal kombinálva lehet a javulás egyik módja. Egyes kutatók most radiofarmakonokat tesztelnek sugárérzékenyítőkkel kombinálva—olyan gyógyszerekkel, amelyek a rákos sejteket még sebezhetőbbé teszik a sugárzással szemben. Például Dr. Chauhan vezeti a lutécium Lu 177-dotatát klinikai vizsgálatát egy triapin nevű sugárzási szenzibilizátorral kombinálva, amely megakadályozza a sejteket abban, hogy a sugárzás által kiváltott károsodás után előállítsák a DNS-javításhoz szükséges vegyületeket.
egy másik vizsgálatban Dr. Lin a lutécium Lu 177-dotatátot egy PARP inhibitornak nevezett gyógyszerrel teszteli. Ezek a gyógyszerek, amelyeket már jóváhagytak bizonyos típusú emlő -, petefészek-és egyéb rákos megbetegedések kezelésére, blokkolják a DNS-javítás folyamatát. “Tehát a sugárzás okozná a DNS károsodását, a PARP inhibitor pedig megakadályozná a tumorsejteket abban, hogy a sugárzás után meggyógyítsák DNS-jüket” – magyarázta.
más kutatók kombinálják a radiofarmakonokat az immunterápiákkal, hogy megpróbálják növelni ezeknek a gyógyszereknek a hatékonyságát. “A legújabb tanulmányok kimutatták, hogy a radiofarmakonok a daganatokat jobban reagálhatják az immunterápiára” – mondta Dr. Capala.
sok daganat “hideg” daganat, magyarázta, hogy az immunsejtek nem ismerik fel őket, vagy nem működnek megfelelően a daganatok körüli mikrokörnyezetben.
de amikor a sugárzás megöli a rákos sejteket, az ezekből a sejtekből származó fehérjék és DNS a véráramba kerülhetnek, hogy az immunsejtek láthassák, ami lehetővé teheti az immunsejtek számára, hogy felismerjék és megöljék a többi rákos sejtet az egész testben. A sugárterápia a tumor mikrokörnyezetét is vendégszeretővé teheti az immunsejtek számára, tette hozzá Dr. Capala.
ezek a hatások együttesen a hideg daganatot “forró” daganattá változtathatják: olyan, amely rengeteg immunsejtet tartalmaz, és reagálhat az immunterápiás gyógyszerekre. Egyes tanulmányok megpróbálták külső sugárzással létrehozni ezt a fajta választ.
“de vannak olyan adatok, amelyek arra utalnak, hogy jobban működik, ha minden daganat, minden áttét sugárzásnak van kitéve. Tehát a radiofarmakon terápiának előnye van abban, hogy amint a testben van, eléri az összes áttétet” – magyarázta Dr. Capala.
még akkor is érdemes kombinálni a radiofarmakonokat a külső sugárzással, mindaddig, amíg a gondos kezelés megtervezése biztosítja a biztonságos teljes sugárzási dózist, tette hozzá Dr. Capala. “A külső sugárterápia nagyon jó a nagy daganatok megcélzásában, majd kombinálhatja azt a radiofarmakon terápiával a metasztázisok megcélzására” – mondta.
kihívások és figyelmeztetések
a radiofarmakonok területe még mindig a korai szakaszában van. Az egyik kihívás, amelyet a megközelítésnek meg kell küzdenie, mielőtt szélesebb körben alkalmazható lenne, az ilyen gyógyszerek beadására képzett orvosok hiánya.
“A nukleáris medicina orvosok száma az Egyesült Államokban kicsi” – mondta Dr. Lin, aki mind a nukleáris medicina, mind az orvosi onkológia területén képzett. “Azt hiszem, évente csak 70-80 új embert képezünk ki.”
eddig ez a munkaerőhiány megakadályozta, hogy a radiofarmakonok személyre szabott kezelésként éljenek valódi lehetőségeikkel ” – magyarázta Dr. Capala. Ez a potenciál tükrözi azt a tényt, hogy más típusú rákgyógyszerekkel ellentétben az orvosok képalkotással pontosan megmérhetik, hogy egy radiofarmakon mekkora részét érte el a daganat, szinte valós időben, és ennek megfelelően módosíthatják az adagot.
de ez a fajta kezelési tervezés multidiszciplináris szakértelmet igényel, amely nem széles körben elérhető, és a radiofarmakonokat használó embereket inkább “radioaktív kemoterápiaként” hagyta, egy mindenki számára megfelelő adaggal. “Ez azt jelenti, hogy sok beteg nem kap optimális kezelést” – mondta Dr. Capala.
hosszú távú biztonsági vizsgálatokra is szükség van, tette hozzá Dr. Chauhan. A külső sugárterápiával kezelt emberek bizonyos mellékhatásokat tapasztalhatnak, úgynevezett késői hatásokat—például a második rák kialakulását—hónapokkal vagy évekkel a kezelés után. Bár az eddigi kutatások nem mutatták ki a radiofarmakon kezelés késői hatásainak magas arányát,” ezek nagyon új szerek, és továbbra is óvatosnak kell lennünk és figyelemmel kell kísérnünk őket ” – mondta.
az együttműködések simítása
mivel ezek a gyógyszerek viszonylag újak, még a folyamatban lévő kísérletekkel is, “csak a radioaktív gyógyszerek fejlesztésének felszínét kaparjuk” – mondta Dr. Chauhan.
2019-ben az ígéretes új radiofarmakonok kísérleteinek további fellendítése érdekében az NCI elindította a Radiofarmakonfejlesztési kezdeményezést (rdi), hogy felgyorsítsa az ígéretes új gyógyszereket a klinikai tesztelésbe.
az egyik dolog, amit az NCI remél elérni a KFI-vel, az, hogy több kísérletet közvetítenek különböző gyógyszeripari vállalatok által előállított gyógyszerek kombinációival, amelyek egyébként nem működhetnek együtt, magyarázta Dr. Kunos, aki a kezdeményezést vezeti. A szellemi tulajdonnal kapcsolatos aggodalmak és a bizalom hiánya megállíthatja az ilyen projekteket, mielőtt megkezdenék őket-magyarázta Dr. Kunos.
“az ilyen típusú együttműködések nem feltétlenül történnének meg, ha az NCI nem lenne a becsületes bróker a közepén” – mondta. Jelenleg az NCI által támogatott korai fázisú vizsgálatoknak csak mintegy 2%-A teszteli a radiofarmakonokat, de az RDI-vel ez exponenciálisan növekedhet az elkövetkező években-tette hozzá.
“nem fogjuk kiküszöbölni a gépeket vagy más technikákat, amelyeket a sugárterápiában használunk” – mondta Dr. Kunos. “De célzott jellegükkel úgy gondoljuk, hogy a radiofarmakonok átalakítják a sugárzás felhasználását.”