Calmodulin
ez egy videó bevezetés a kalcium jelző fehérje, calmodulin, egy szervetlen kémikus szemszögéből!
a kalmodulin vagy a CaM egy polipeptid, amely mindenütt jelen van minden eukarióta sejtben. Ez a fehérje kalmodulin néven ismert, mert egy kalciummodulált fehérje, amely létfontosságú szerepet játszik a kalcium jelátvitel folyamatában. A kalcium jelátvitel az a folyamat, amelyen keresztül a kalciumionok és számos fehérje közötti kölcsönhatás közvetíti a sejtek közötti kommunikációt. a kalmodulin funkciója ezért minden eukarióta sejtben szükséges, és néhány olyan feladat, amelyet segít elérni, az idegjelzés, a vázizom mozgása és a memória. A környezetben lévő kalciumionok érzékelésével a kalmodulin aktiválódik, majd köztitermékként működik, megindítva a fontos fehérjék, például a kinázok kötődését, segítve sejtjeinket az alapvető és kifinomult funkciókban (“kalmodulin”).
az alábbi videó bemutatja a CAM-en belüli szerkezeti változást a kalciumkötés során (3CLN és 1CFD PDB kódok).
maga a fehérje 148 aminosav hosszúságú, két gömb alakú régióval, amelyek mindegyike 2 EF-kéz motívumot tartalmaz, amelyek a kalcium által közvetített polipeptidek jellegzetes helyei. Aktiválásakor a kalmodulin 4 Ca2+ iont tartalmaz, amelyek drasztikusan megváltoztatják a fehérje alakját. Amikor a kalmodulin kötődik a kalciumionokhoz, a fehérje apo formájából halo formájába nyílik, felfedve egy alfa hélixet, amelyet linker vagy központi heveder régiónak neveznek. Rugalmassága miatt a központi heveder régió a fehérje helye, amelyen a partnerfehérjék kötődnek és hozzájárulnak a kalcium másodlagos üzenetküldő kaszkádjához. Szerkezete és a kalciumionok működéséhez szükséges igénye alapján a kalmodulinnak képesnek kell lennie a citoplazmában lévő kalciumionok kiválasztására, és az ionok és az EF hand doménekben lévő ligandumok közötti kölcsönhatások alátámasztják ezt a szelektivitási elképzelést (Bertini et. al., 635-638).
ez a kép azt mutatja be, hogy egy EF-kéz motívum hogyan hasonlít egy kézre. A bal oldali szalagdiagram a kalmodulin négy jellegzetes helix-turn-helix EF kézmotívumának egyikét mutatja. (EKT-kód 3CLN)
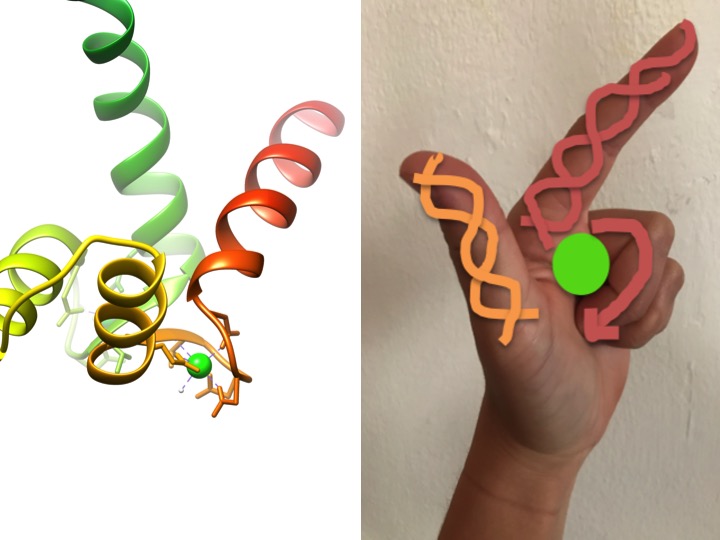
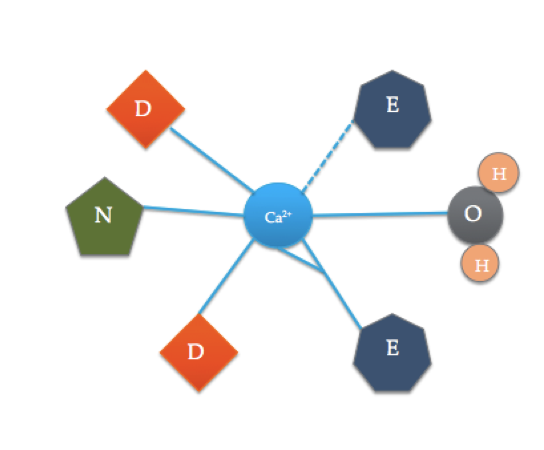
az EF kézi motívumok a kalcium kötődésében részt vevő fehérjék erősen konzervált szerkezeti régiói. Ezeket a régiókat “kéz” motívumoknak nevezik, mert hasonlítanak egy L alakú kézre, ahol a fémion az ököl közepén helyezkedik el, az alfa hélixeket a felfelé mutató mutatóujj és a befelé néző hüvelykujj jelzi, a hullámos ujjak pedig a forduló vagy hurok régiót képviselik. Ezt a fenti ábra mutatja. Egy jellegzetes EF-kéz motívumban az aminosavak, köztük a glutamátok, aszparaginok, aszparaginsavak és glutaminsavak kötődnek a Ca-hoz, valamint a vízhez (Bertini et. al. 639). A tipikus EF-kézi doménkötési sorrendet az alábbi ábra mutatja.
ez a rajzfilm szemlélteti a koordinált aminosavakat egy tipikus EF kézi doménben (a pontos aminosav-összetétel változó!). A szaggatott vonal a CA koordinációját jelenti a gerinc karbonil oxigénjével, míg a folytonos vonalak az oldalláncok vagy a víz koordinációját jelzik.
a kalmodulin kötőhelye némileg eltér a fent bemutatott legjellemzőbb EF hand doméntől. A kalmodulin 6 liganduma három aszparaginsav (D) oldalláncát, 1 glutaminsavat (E) tartalmaz, amely két koordináta kovalens kötést képez az ionnal, 1 vízmolekulát az oldatból és 1 karbonilmolekulát a gerincből. A kalmodulin kötőhelye Ca-ból áll2 + iont 6 ligandum vesz körül, miközben 7 kötést képez.
észrevehető, hogy a calmodulin EF motívuma sok azonos ligandumot tartalmaz, csak különböző helyeken. Ez a konformáció ötletet adhat arra, hogy a kalmodulin miért szelektív a kalciumra, és hogy csak egy kalciumion jelenléte képes kielégíteni azt a kötőhelyet, amely a fehérje aktiválódását okozza. Ez összefügg a sejten belüli kalmodulin termodinamikájával és azzal, hogy hogyan reagál a kalciumionok jelenlétére.
ahhoz, hogy megértsük a termodinamikát, amely összekapcsolja a kalmodulin aktiválódását, először meg kell értenünk az ionok, például a kalcium és a magnézium koncentrációját egy eukarióta sejtben, beleértve az embert is. Ezen ionok koncentrációját szorosan szabályozni kell. Belül a sejtben a kalciumjelzést a kalciumionok koncentrációjának átmeneti növekedése kíséri, amelyet olyan fehérjék érzékelnek, mint a kalmodulin (Bertini et. al., 636). Ez a kalcium-túlfeszültség az intracelluláris G-fehérjéknek köszönhető, amelyek a durva és sima retikulumot indukálják a kalcium felszabadítására, vagy a kalciumionokat az extracelluláris térből hozhatják be. A kalmodulin esetében általában reagál arra, hogy a kalcium kívülről kerül a sejtbe, ami olyan folyamatok során fordul elő, mint az idegjelzés (Bertini et. al. 637). Mielőtt a kalcium koncentrációja pillanatnyilag megemelkedne, a sejten belüli koncentráció általában 10-100 nm között van, míg az ionok rövid beáramlása során a koncentráció 1000-100 000 nm-re növekszik. A koncentráció változása miatt a kalmodulin érzékeli a kalciumionokat, megköti őket, és további jelátvitelt kezdeményez (Bertini et. al., 635).
hogyan kötődik tehát a kalmodulin véglegesen a kalciumionokhoz, nem pedig például a magnéziumionokhoz? Az Mg2 + ionok valójában meglehetősen hasonlóak a kalciumionokhoz: inkább elektrosztatikus kölcsönhatásokban vesznek részt, mint kovalensekben, és kemény atomoknak tekintik őket. Az az oka, hogy a kalmodulin inkább a kalciumionokat részesíti előnyben, mint a magnéziumionokat, az egyes ionok kötési állandóival függ össze. A kalmodulin létezhet más ionokhoz, például magnéziumhoz kötve, de ha nagyobb a kalcium koncentrációja, a kalciumionok azonnal versenyeznek a magnéziumionokkal, hogy elfoglalják a kalciumkötő helyeket. Ez azért van, mert a CAM és Ca2+ (Ka) kötési állandója nagyobb, mint a CaM és az Mg2+, amint azt a 7.ábra mutatja. Ez azt jelzi, hogy ha kalciumionokhoz kötődik, a kalmodulin több terméket termel. Mindezeket az elképzeléseket figyelembe kell venni, szem előtt tartva, hogy ez a folyamat másodpercenként megszámlálhatatlan alkalommal történik, és ennek a fehérjének a forgalma megváltozik, hogy reagáljon a sejt folyamatosan Modulált kalciumkoncentrációjára.
miért kedvezőbb a kalmodulin kötődése a kalciumionokkal, mint más fémekkel? Ennek oka lehet az ionok mérete a ligandumok által kiváltott szterikus akadályhoz viszonyítva. A kötési helyet 6 ligandum jellemzi, amelyek 7 koordináta kötést alkotnak. Mivel a kalciumionok nagyobbak, mint a magnéziumionok, amint azt a 8.ábra mutatja, lehetséges, hogy a kalciumot részesítik előnyben, mert növeli a ligandumok egymástól való távolságát, ezáltal csökkentve a ligandumok közötti szterikus kölcsönhatásokat. Maga a fehérje szerkezete is oka lehet a kalciumionok szelektivitásának. Összességében ismert, hogy a kalciumionok változó sejtkoncentrációján alapuló termodinamika miatt a kalmodulin érzékeli az ionok növekedését, megköti őket, és segít ellátni funkcióját.
CaM + Ca2+ <–> Ca2+CaM (KCaM-Ca)
CaM + Mg2+ 7582>–> Mg2+CaM (KCaM-Mg)
Mg2+CaM + Ca2+ <–> Ca2+CaM + Mg2+
mivel a kcam-Ca > Kcam-mg
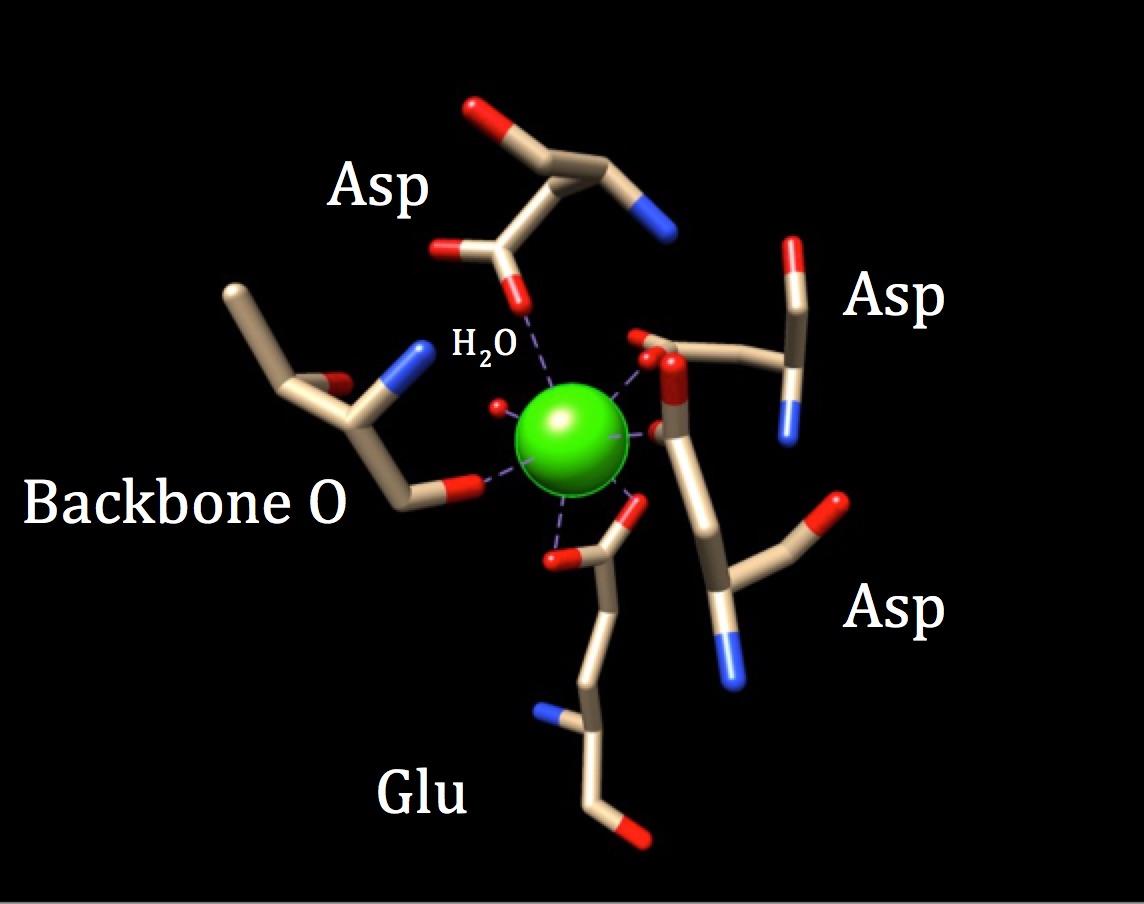
a kalmodulin Kötőhelyének kémiájának további tárgyalása során meg kell vizsgálni a koordinációs geometriát. Mivel a kalciumion kölcsönhatásba lép hét donor atommal, a rendszert heptadentátrendszernek nevezik. Mivel a kalmodulint hat ligandum veszi körül, feltételezhető egy oktaéderes koordinációs geometria. De mivel az egyik ligandum bidentát módon kölcsönhatásba lép az ionnal—vagyis két koordináta kovalens kötése van, amelyek egy aminosavban különböző atomokból származnak—, a koordinációs komplex torz oktaéder alakot vesz fel. A konkrét koordinációt az alábbi ábra mutatja be.
a kalmodulin kalciumkötő helyének koordinációs geometriája. A középső kalcium-fémiont három aszparagin (Asp), egy gerinchálózati oxigén, egy gluatminsav (Glu) és egy vízmolekula veszi körül. (EKT-kód 3CLN)
hivatkozhatunk a keláthatás elméletére is, hogy jobban megértsük a kalmodulin azon képességét, hogy nagy affinitású fémionokhoz kötődjön. A kelátképző egy olyan atom, amely képes egynél több donor atomhoz kötődni. A polidentát kötés összefügg keláthatás, amely kimondja, hogy amikor egy ligandum sok donorcsoporttal (poli) kötődik, a koordináta kovalens kötések sokkal erősebbek vagy szorosabban tartanak. Ezt az elméletet a termodinamika támasztja alá, különös tekintettel arra, hogy a polidentátkötés növeli a rendszer entrópiája, pozitívabbá téve (több rendellenesség), ami termodinamikailag kedvező. Ennek az elméletnek a kalmodulinra történő alkalmazása nemcsak a polidendátum kötés fontosságát magyarázza magukban a helyekben, hanem annak szükségességét is, hogy a fehérje 4 különböző kalciumionot kössön a funkció aktiválásához. Azáltal, hogy lényegében négy Ca kötését igényeli2 + ionok a helyeken belül, a rendszer ösztönzi az entrópia növekedését azáltal, hogy több szubsztrátot/reagenst vezet be, hogy nagyobb számú terméket képezzen. Ez annak köszönhető, hogy az egyes kötési helyek ligandum kölcsönhatásain belül nagyobb a kötés száma. Összességében a kalciumion kötődését a polipeptid helyein a keláthatás elmélete támasztja alá, és rávilágít a kalmodulin kalciumkötési hatékonyságára.
az EF-kézi motívumok bizonyos szerkezettel rendelkeznek, azon a tényen alapulva, hogy a kalcium a központi fém. Ez igaz a kalmodulin-kötő helyekre is. A Ca2 + ion hasonló atomokkal kötődik bizonyos aminosavak szerkezetéhez a kemény / lágy Sav-bázis elméletnek nevezett elmélet alapján. Ez az elmélet a fémeket és a ligandumokat két kategóriába sorolja a polarizálhatóság és a töltés / sugár arány alapján. A kemény savak és bázisok kisebb ionok, amelyek nagyobb töltésmérettel rendelkeznek, és ez elektrosztatikus módon kölcsönhatásba lép (azaz + és – töltések közötti vonzerőt jelent), míg a lágy savak és bázisok nagyobb méretűek, ezért kisebb a töltés / sugár aránya, ami kovalens jellegű kötéseket eredményez. A “hasonló kötődik a hasonlóhoz” kifejezés arra a tényre utal, hogy a kemény savak és bázisok általában kölcsönhatásba lépnek más kemény atomokkal, és ugyanez vonatkozik a lágy savakra és bázisokra. Ca2 + kemény savként jellemezhető, mert bár nagy sugara van, többnyire elektrosztatikus módon kölcsönhatásba lép a ligandumokkal. A kalmodulin kalciumkötő helyét vizsgálva láthatjuk, hogy a kalciumion kötődik a 3 aszparaginsav, a glutaminsav, a víz és a gerinchálózat karbonil oxigénatomjaihoz. Ez a kötés összhangban van a “hasonló kötődik a hasonlóhoz”, mert a víz és az aminosavak ligandumai, a glutaminsav és az aszparaginsav az oxigén donorokon keresztül kötődnek, amelyeket kemény bázisként jellemeznek. A 10. ábra áttekinti a kalmodulin kötőhelyeit, miközben bemutatja az aminosavak negatív oldalláncait is, amelyek kölcsönhatásba lépnek a kék színnel jelölt kalciumionokkal.
ami a kötött ligandumok donor atomjait és azon képességüket illeti, hogy elektronpárokat adományozzanak a koordinációs komplexnek, a spektrokémiai sorozat elmagyarázza, hogy az atomok hogyan lépnek kölcsönhatásba a központi fémmel. A kalciumkötő hely esetében a Ca2+ ionnal kölcsönhatásba lépő oxigéneket mind úgy tekintjük, hogy a donor oxigénjei 2 vagy több elektronpárral rendelkeznek. A spektrokémiai seirek kategóriái, amelyek meghatározzák az elektronok rendelkezésre állását és adományozását, hatással vannak a spin kijelölésére (alacsony vagy magas), amely azt jelzi, hogy a d elektronok hogyan töltik meg pályáikat, és a Delta (6) méretét a fém d pályái között, de ez nem változtat a kalciumon, mert a kalcium d pályái nincsenek elfoglalva a D vegyértékű elektronok hiánya miatt. Ez a D-pályákat lényegében elhanyagolhatóvá teszi a fehérjével kapcsolatos legtöbb beszélgetés során. Az egyik kivétel a kalciumion labilitásának figyelembevétele a rendszerben.
az elektronok hiánya a Ca d pályáin nulla ligandum mező stabilizációs energiát eredményez, és ez magyarázza a kalciumion magas labilitását. A labilitás arra a sebességre utal, amellyel a ligandumok helyettesíthetők a koordinációs komplexekben, ezért leírja a rendszer kinetikáját. Az atomok labilisak, ha gyorsan cserélnek ligandumokat. Az eukarióta sejtekben betöltött fontos szerepe miatt a kalmodulin várhatóan másodpercenként több milliószor kötődik és szabadít fel kalciumionokat, hogy kalciumionok átvitelén keresztül üzeneteket küldjön és fogadjon a környező sejtekből. Amikor a kalmodulin CA megkötésére és felszabadítására képes2+ gyorsan, fontos figyelembe venni a valence d elektron pályák foglaltságát. Mint már említettük, a kalcium üres valence d pályákkal rendelkezik. Ezek az üres pályák magyarázatot adhatnak a Ca-RA2 + ion labilitása. Mivel a kalciumion összes D pályája üres, a ligandum mező stabilizációs energiája (LFSE) 0. Ez azt jelzi, hogy a kalcium instabil az LFSE mérlegelésekor, mivel a stabil molekulák általában negatív értéket mutatnak az LFSE szempontjából. Az instabilitás ebben az esetben azt jelenti, hogy hajlandó gyorsan reagálni és komplexeket mozgatni, alátámasztva azt az állítást, hogy a Ca2+ ionok gyors reakciókat ösztönöznek, és labilisnak jellemezhetők. Bár ez ellentmondásosnak tűnik a keláthatással kapcsolatos vita szempontjából, magától értetődik, hogy ez a két elmélet nem mond ellent egymásnak. A szorosan tartott koordinációs kötések stabilitása, amelyet a keláthatás javasol, arra ösztönzi a kalmodulint, hogy elég hosszú ideig stabil maradjon a kiegészítő fehérjék megkötéséhez. Miután ez befejeződött, és a kalcium koncentrációja normalizálódik, hatékonyan eltávolítja a kalciumionok helyét.
a kalmodulin szerkezete és létfontosságú kötőhelyének összetétele alapján az eukarióta sejtek számtalan folyamatának szerves részét képezi. A kalciumionok szignáltranszdukcióban történő elfogadásán és kötődésén keresztül a kalmodulin kulcsfontosságú szerepet játszik az alapvető és magas szintű működésben olyan szervezetekben, mint az emberek. A bioorganikus elmélet alkalmazásával és az eukarióta sejtek finoman megfigyelt környezetének megértésével megfelelően megérthetjük a kalmodulin azon képességét, hogy kiválassza a kalciumionokat, és ösztönözze a további működést több mint 100 partnerfehérje bevonásával.