生理学および疾患におけるVSMCsの可塑性
血管平滑筋細胞(VSMCs)は、中-大型動脈の主要な構成要素である。 アテローム発生のメカニズムは主に定義されているが、研究は、疾患の進行は、ECsとVSMCsの両方と免疫細胞間のクロストークを伴うことを示しています。 これらの相互作用のいくつかは、プラークの成長を促進し、他のものは、アテローム性動脈硬化プラークのサイズ、細胞組成、および安定性を減衰させる(1、2)(図1、表1)。 VSMCsは、血管損傷、炎症、およびリポタンパク質の蓄積に応答して顕著な可塑性を示すリプログラミング遺伝子発現と増殖、移動促進、活性化表現型、すなわ 図1では、疾患の進行の重要な調節因子であることが提案されている重要な分子スイッチを示しています(3, 6, 8, 11). アテローム性動脈硬化症の開始の間に、内膜に募集されている血液由来の単球は、それらに泡状の外観を与える脂質を蓄積します。 これらの泡の細胞はatheroscleroticプラークの最も早く、多分リバーシブルの段階を構成する脂肪質の縞の形成に貢献します。 脂肪筋は徐々にアテローム/プラークに発達し、最終的にはVsmc、T細胞および骨髄細胞を含む拡張プラークにつながる(図1)(33)。 興味深いことに、アテローム性動脈硬化性プラークの組成ではなく、そのサイズは、繊維キャップの厚さと壊死性コアサイズは、それぞれ、不安定なプラーク対安定の潜在的な特徴であるとして、その安定性を決定します(4、9)。 内膜層のvsmcは、伝統的に、それによってプラーク破裂(に対する保護をもたらし、より強い線維性キャップの形成を促進し、細胞外マトリックス成分を産生 これは、Vsmcは、構造的および機能的表現型変換の茄多を受け、さらには完全にマクロファージを含む他の細胞型の特性を取得するために、そのネイティブ データは、VSMCsは、組織環境と危険因子(3)の作用に応じて、ヤヌス頭型の性質、すなわち、プロ対抗アテローム性特性を持つ二分性表現型を取得することができ VSMCはサイトカインを放出し、隣接するEcを刺激して接着分子を発現させ、サイトカインを放出し、および/または単球/マクロファージのプラークへの走化性を これらのデータは、線維性キャップまたは内膜におけるVSMCsの蓄積が有益であることを示し、その損失または炎症表現型への移行は有害であるのに対し、VSMCsの増殖/移動対死/老化との間のバランスは、プラーク安定性対アテローム形成を決定することを示している(3)。 健康と病気におけるVSMC生物学のさまざまな追加の側面は、最近、一連の優れたレビュー(https://academic.oup.com/cardiovascres/issue/114/4)でカバーされており、ここではカバーされません。 したがって、以下では、外膜の役割とATLO形成におけるVSMCsの潜在的な影響に注意を集中します。

図1. アテローム性動脈硬化症の進行中のVSMCsの表現型は、異常な可塑性を明らかにする。 アテローム性動脈硬化プラークにおけるECsおよびVSMCsは、活性化された表現型(γ)を示す(3、4)。 Vsmcのいくつかは、内膜への募集に続いてメディアに由来します; 他のVsmcは、骨髄由来であってもよいし、循環中の骨髄系細胞に由来していてもよい(u)(3)。 Vsmcの一部が増殖する(γ)(3、5)。 Vsmcは細胞外マトリックス成分を分泌し、多能性転写因子、すなわちKlf4は、表現型スイッチング(γ)と呼ばれるプロセスにおいて主要な役割を果たし得る(6、7)。 致死的破裂からアテローム性動脈硬化性プラークを遮蔽する試みでは、Oct4は、線維性キャップ(γ)を形成するための再移住と呼ばれるプロセスを制御し得る(4、8−1 0)。 老化とアポトーシスは、追加の炎症性サイトカインの生成を誘発し、壊死性コアを形成し、疾患の後期段階で致命的な臨床的結果を伴う悪循環を開始する(γ)(3、4、11)。
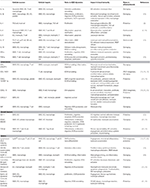
表1. VSMCを介したアテローム性動脈硬化症免疫に関与する主要な炎症メディエーター。
VSMCsは高脂血症マウスにおける外膜免疫応答に影響を与える
過去二十年の間に、外膜は間質細胞、神経、リンパ管、血管内皮細胞、および常在白血球/前駆細胞 我々は、ApoE−/−マウスの外膜は、アテローム性動脈硬化症のすべての段階の間に主要なリストライベントを受けることを観察した: 先天性免疫細胞と適応性免疫細胞の両方が、隣接するアテローム性動脈硬化プラークに隣接して蓄積する(図2)。 さらに、実験マウスにおける我々の研究は、ヒト疾患動脈で確証された:我々と他の人がアテローム性動脈硬化性大動脈瘤(38、39)を提示する患者の外膜におけるATLO様 虚血性心疾患(に罹患した患者のかなりの割合の外膜におけるよく発達したATLOsを観察した40)。 マウスのアテローム性動脈硬化症では、リンパ管-、高内皮細静脈(HEV)-、および血管新生は、この再構築プロセス(の顕著な特徴である16、41)。
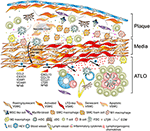
図2. 血管平滑筋細胞(VSMC)はプラーク形成中に外膜免疫に関与する。 アテローム性動脈硬化プラークと外膜の間に挟まれたVSMCsは、プラーク由来の手がかり(γ)を介して活性化後のリンパ組織オーガナイザー様の表現型を採用し、続いてLTo様細胞(γ)に分化する。 それらの増殖性およびサイトカイン発現表現型によって、それらは血管新生、HEV形成、およびリンパ管新生(γ)を含む外膜の再構築および彫刻に影響を与 表現型の切り替えはまた、リンパ組織化ケモカイン、すなわちCXCL13およびCCL21の発現および分泌をもたらし、それによってグラフ(γ)の下部に模式的に描かれたATLO形成を促進する。
老化または慢性またはその両方?
重要なのは、老化が外膜の再構築と彫刻の主要な決定要因であることが判明したことです。 アテローム性動脈硬化症の進行した段階の間に完全に発達したATLOsフォームが、その初期段階、すなわち、T/B細胞凝集体は、アテローム性動脈硬化プラークの形成(16, 27, 41, 42). 実際、これらの早期ATLOsは〜30週齢で形成され、約52週でより高度な段階に達し、78週(16、41)でピークに達します。 Tloの同様の年齢に依存した発達段階は、他の慢性的な解決不可能な疾患(で観察されている1、42)。 これらのデータは、ATLOの発達は年齢依存性であり、老化は外膜彫刻と積極的に関連していることを示しています(図2)。 しかし,マウスのアテローム性動脈硬化症では,アテローム性動脈硬化性プラークの発達が大動脈弓で始まり,その後,大動脈を播種して後の疾患段階で腹部大動脈に到達するため,老化と慢性性との関係を研究することは困難である。 免疫細胞および/またはVSMC老化がATLO形成に寄与するかどうか、およびどの細胞タイプ、すなわち、重要な問題を明らかにするためには、より多くの作業が必 免疫細胞は、VSMC、Ec、および/または免疫細胞が関与している。 肺や胃腸管で起こるような他の形態のTLO形成の研究は、それがATLOsの形成に決定的に寄与しているのは、免疫系の善意の老化事象ではなく、持続的な炎症性組織反応の慢性性であることを示すであろう(43,44)。
新しく形成された外膜構造は、リンパ球の再循環を促進することによってatlo機能に関与している
高度なATLO段階には、T/B細胞凝集体、活性化されたB細胞卵胞内の胚中心、リンパ管、T細胞領域のHev、および細胞外導管メッシュワークス(16)が含まれる。 これらの主要な変化は、二次リンパ器官に見られるものを彷彿とさせる構造に似ており、ナイーブリンパ球の再循環を含む抗原に対する免疫応答の基本的な側面を促進し、認知抗原/自己抗原を見つけること、および潜在的な自己抗原に対するB細胞の親和性成熟を組織することを含む。 養子リンパ球移入研究を使用して、我々はATLOsが大幅に移民を促進し、抗原経験の浅いリンパ球(27)の移住の付随する減衰の両方によって動脈壁にリンパ球の募集を強化することを観察した。 それらの動員に続いて、T細胞は活性化され、増殖を開始し、CD4tヘルパー細胞のいくつかは、誘導されたT調節細胞に変換される。 これらのデータは、外膜における免疫系が動脈壁の根底にある炎症組織反応に対して非常に応答性であることを明らかにしている。 さらに、活性化されたB細胞卵胞に胚中心を形成するB細胞は、卵胞樹状細胞の存在下で胚中心反応を起こし、いくつかは記憶B細胞に変換され、他のものは胚中心を離れて形質細胞になるように見える(45)。 まとめると、これらのデータは、(以前に考えられていたように)二次リンパ器官ではなくATLOsがアテローム性動脈硬化症免疫を組織することを示
Atlo形成は高度に領土化されており、シグナルがリンパ組織オーガナイザー様VSMCsを介してプラークから外膜に伝達されることを示す
アテローム形成中の外膜再構築のもう一つの側面は、ATLO形成が高度に領土化されていることである(16、45)。 ATLOsは、アテローム性動脈硬化症が最も顕著である無名動脈または大動脈弓の外膜に時折見られるだけである。 大動脈の胸部セグメントの免疫細胞は、主に腹部大動脈のATLOsと比較してT細胞凝集体で構成されている(16、41)。 腹部大動脈におけるAtlos形成の領土性の正確なメカニズムはまだ不明である。 TLOは、多くの慢性的な解決不能な炎症性疾患の特徴であると思われ、自己免疫疾患(の顕著な特徴である42)。 アテローム性動脈硬化症におけるTloの細胞性および構造は、癌関連TLO形成を含む他の多くの慢性疾患におけるTloと類似している(46、47)。 近年、TLO生物学の分野は劇的に拡大しており、それぞれのtlo関連疾患におけるTLOの機能を理解することによって、新しい治療標的が同定される可能性 しかし、様々なタイプのTloは、関連する免疫応答が有害であるか防御的であるかを最終的に決定する可能性のあるいくつかの疾患特異的特徴を明らか このような疾患特異的特徴は、臓器特異性および組織損傷の性質を含むいくつかのメカニズムのいずれかを介して生じる可能性がある(1、42)。 リンパ器官の発達は、造血リンパ組織誘導(LTi)細胞、非造血間質リンパ組織オーガナイザー(LTo)細胞およびLt Β rシグナル伝達を含む複雑なプロセスである。 マウス大動脈VSMCsの我々のin-vitro研究は、適切な刺激時に、彼らはもともとリンパ節や脾臓(48、49)を含む二次リンパ組織の形成中に胚発生中に同定されたLTo様細胞(20) AtloはVsmcを重要な参加者として関与しているように見えるが、他のTloは他のLto様間葉系細胞を関与させることに注意することが重要である(5 0)。 しかし、Tloのすべての形態の共通分母は、二次リンパ器官とは異なり、免疫系を駆動してこれらのリンパ構造を形成する慢性炎症組織反応であるよう
VSMCsはアテローム性動脈硬化症における外膜免疫に直接寄与する
アテローム性動脈硬化プラークに隣接するATLOsの高度に領土化された性質を考慮して、VSMCsはATLOの形成に関与し、同じトークンによってアテローム性動脈硬化症の進行に機能的役割を採用する可能性があると推論した。 そのリガンドLta1Β2はLTi細胞と呼ばれる様々な免疫細胞上で発現されているのに対し、VSMCsは、構成的にLt Β Rを高度に発現する(16)(51)。 VSMCは、二次リンパ組織新生に関与するLti細胞によってLt Β R−LTシグナル伝達経路を介して活性化されると仮定される。 内膜プラーク中の活性化マクロファージおよび他の免疫細胞がLTO新生におけるこの活性の候補であるが、LTi細胞の起源はまだ明確に決定されていない。 細胞および可溶性メディエーターに応答して、Vsmcは、リンパ組織原性ケモカイン、すなわちCXCL13およびCCL21のパラクリン分泌によってLTo様表現型への表現型スイッ 高齢者高脂血症ApoE-/−マウスにおけるLt Β rのグローバルまたはVSMC特異的欠損は、VSMC Lt Β rは、いくつかの実験条件下でアテローム性動脈硬化症の発症を減衰させる 他の研究は、しかし、若いグローバルApoE−/−LTbR−/−高脂肪食(HFD)の下で維持マウスは、通常の食事供給ApoE-/−対応(より低い大動脈プラーク負担を明らかにしたことを示した52)。 これらの明らかな矛盾したデータは、若いマウスおよび過剰な高脂血症の条件下でのLt Β rの役割が二つのモデルで異なる可能性があることを示している。 また、血しょう脂質の劇的な、多分酔わせるレベルをもたらす高脂肪の食事療法はこれらの相違に、責任があるかもしれません。 我々はApoE−/−マウスで高脂肪食を定期的に使用していないので、免疫系が極端なレベルの血漿脂質に圧倒される可能性があることが示されていますが、こ これらのデータは、若い対高齢マウスおよび/または早期対高度なアテローム性動脈硬化症におけるアテローム性動脈硬化症の進行におけるLt Β Rの見かけの二分法の分子基盤を調べるためのさらなる研究を求めています。 さらに、骨髄由来マクロファージは、Lt Β r非依存性Lti細胞として機能し、VsmcによるCCL1 9、CCL2 0、およびCXCL1 6の発現を誘発し得る(5 3)(表1)。 したがって、VSMCsは、外膜における免疫細胞凝集体を促進するために、リンパ組織化ケモカインのアップレギュレーションによってアテローム性動脈硬化症のTLOsの形成に関与している可能性があります。 上記のように、ATLOsは、虚血性冠状動脈性心疾患(40)およびヒトアテローム性動脈硬化性大動脈瘤(38、39)によって負担されるヒトにおいて一般的である。 一緒に取られたとき、実験マウスとヒトアテローム性動脈硬化症におけるATLOsの発生は、自己免疫疾患としてのアテローム性動脈硬化症の性質に関する重要な疑問を提起する:アテローム形成中に自己免疫T細胞とまだ同定されていない自己抗原に対して向けられた自己免疫B細胞が生成されることが考えられる。 そのような自己免疫リンパ球の単離は、それらのT細胞受容体および/またはB細胞受容体の配列決定を含む、アテローム性動脈硬化症における主要な仮説を試験することを可能にするであろう。 実際、アテローム性動脈硬化症の研究は大きなシフトを受け、機能的なin vitroおよびin vivoシステムにおける個々の自己免疫リンパ球クローンのテストが可能
結論
アテローム性動脈硬化症は動脈の炎症性疾患である。 Vsmcは、アテローム性動脈硬化プラークにおけるECsおよび免疫細胞および外膜における常駐細胞の両方と通信する。 この能力はVSMCsがATLOsの形成を含む主要な方法でアテローム性動脈硬化の免除に影響を与えるようにします。 さらなる研究は、アテローム性動脈硬化症の異なる段階でVsmcの役割を描写し、若い動脈対老化動脈におけるそれらの役割を決定し、疾患の進行におけるそ これらのプロセスのよりよい理解は病気の臨床的に重要な後期段階の未来の介在のための治療上の作戦を開発する方法を開けるかもしれません。
著者の寄稿
すべての著者が、提出された原稿のデザイン、執筆、編集に貢献し、出版を承認しました。
資金調達
利益相反声明
著者らは、この研究は潜在的な利益相反と解釈される可能性のある商業的または財政的関係がない場合に行われた
4. Clarke MC,Figg N,Maguire JJ,Davenport AP,Goddard M,Littlewood TD et al. 血管平滑筋細胞のアポトーシスは、アテローム性動脈硬化症におけるプラーク脆弱性の特徴を誘導する。 ナットメッド (2006) 12:1075–80. doi:10.1038/nm1459
PubMed要約/CrossRef全文/Google Scholar
5. オーエンスGK、クマールMS、ワムホフBR. 発達および疾患における血管平滑筋細胞分化の分子調節。 ら(2 0 0 4)8 4:7 6 7−8 0 1。 土井:10.1152/physrev.00041.2003
PubMed要約/CrossRef全文/Google Scholar
6. Shankman LS,Gomez D,Cherepanova OA,Salmon M,Alencar GF,Haskins RM,et al. 平滑筋細胞のKLF4依存性表現型変調は、アテローム性動脈硬化プラーク病因に重要な役割を持っています。 ナットメッド (2015) 21:628–37. ドイ:10.1038/nm.3866
PubMed要約/CrossRef全文/Google Scholar
7. ゴメスD、オーウェンズGK。 アテローム性動脈硬化症における平滑筋細胞表現型のスイッチング。 Cardiovasc Res.(2 0 1 2)9 5:1 5 6−6 4. doi:10.1093/cvr/cvs115
PubMed要約/CrossRef全文/Google Scholar
8. Cherepanova OA,Gomez D,Shankman LS,Swiatlowska P,Williams J,SARMENTO OF,et al. 平滑筋細胞における多能性因子OCT4の活性化はアテローム保護性である。 ナットメッド (2016) 22:657–65. ドイ:10.1038/nm.4109
PubMed要約/CrossRef全文/Google Scholar
10. Yla-Herttuala S,Bentzon JF,Daemen M,Falk E,Garcia-Garcia HM,Herrmann J,et al. アテローム性動脈硬化プラークの安定化。 アテローム性動脈硬化症および血管生物学に関する欧州心臓学会(ESC)ワーキンググループの位置論文。 “トロンボーン” (2011) 106:1–19. 土井: 10.1160/10-12-0784
PubMed Abstract|CrossRef全文|Google Scholar
11. Grootaert MOJ,Moulis M,Roth L,Martinet W,Vindis C,Bennett MR,et al. アテローム性動脈硬化症における血管平滑筋細胞死、オートファジーおよび老化。 Cardiovasc Res.(2 0 1 8)1 1 4:6 2 2−3 4. doi:10.1093/cvr/cvy007
PubMed要約/CrossRef全文/Google Scholar
14. Akhavanpoor M,Akhavanpoor H,Gleissner CA,Wangler S,Doesch AO,Katus HA,et al. アテローム性動脈硬化症におけるインターロイキン-17Aの二つの顔。 Currの薬物ターゲット。 (2017) 18:863–73. 土井: 10.2174/1389450117666161229142155
PubMed Abstract|CrossRef全文|Google Scholar
15. Jia G、Cheng G、Gangahar DM、Agrawal DK。 インスリン様成長因子-1およびTNF-αは、ヒトアテローム硬化性血管平滑細胞におけるc-jun N末端キナーゼおよびAkt経路を介してオートファジーを調節する。 イムノールセルバイオール。 (2006) 84:448–54. ドイ:10.1111/j.1440-1711.2006.01454.x
PubMed要約/CrossRef全文|Google Scholar
16. Grabner R,Lotzer K,Dopping S,Hildner M,Radke D,Beer M,et al. リンホトキシンβ受容体シグナル伝達は、高齢ApoE−/−マウスの大動脈外膜における三次リンパ器官形成を促進する。 J Exp Med. (2009) 206:233–48. ドイ:10.1084/jem.20080752
クロスリファレンス全文/Google Scholar
17. Damas JK,Smith C,Oie E,Fevang B,Halvorsen B,Waehre T,et al. 臨床的および実験的アテローム性動脈硬化症における恒常性ケモカインCCL19およびCCL21の発現の強化:プラーク不安定化における可能な病原性の役割。 動脈硬化性血栓症 (2007) 27:614–20. 土井:10.1161/01.ATV。0000255581.38523.7c
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Doring Y, Noels H, van der Vorst EPC, Neideck C, Egea V, Drechsler M, et al. Vascular CXCR4 limits atherosclerosis by maintaining arterial integrity: evidence from mouse and human studies. Circulation. (2017) 136:388–403. doi: 10.1161/CIRCULATIONAHA.117.027646
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Akhtar S, Gremse F, Kiessling F, Weber C, Schober A. CXCL12 promotes the stabilization of atherosclerotic lesions mediated by smooth muscle progenitor cells in Apoe-deficient mice. Arterioscler Thromb Vasc Biol. (2013) 33:679–86. doi: 10.1161/ATVBAHA.112.301162
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Lotzer K, Dopping S, Connert S, Grabner R, Spanbroek R, Lemser B, et al. Mouse aorta smooth muscle cells differentiate into lymphoid tissue organizer-like cells on combined tumor necrosis factor receptor-1/lymphotoxin beta-receptor NF-kappaB signaling. Arterioscler Thromb Vasc Biol. (2010) 30:395–402. 土井:10.1161/ATVBAHA.109.191395
PubMed要約/CrossRef全文/Google Scholar
21. Smedbakken LM,Halvorsen B,Daissormont I,Ranheim T,Michelsen AE,Skjelland M,et al. ヒトアテローム性動脈硬化症における恒常性ケモカインCXCL13のレベルの増加–プラーク安定化における潜在的な役割。 アテローム性動脈硬化症。 (2012) 224:266–73. 土井:10.1016/j.アテローム性動脈硬化症.2012.06.071
クロスリファレンス全文/Google Scholar
22. 東Y,Sukhanov S,Shai SY,Danchuk S,Tang R,Snarski P,et al. マクロファージにおけるインスリン様成長因子-1受容体欠損は、アテローム性動脈硬化症を加速し、アポリポタンパク質E欠損マウスにおける不安定なプラーク表現型を誘導する。 循環。 (2016) 133:2263–78. 土井:10.1161/116.021805
PubMed要約/CrossRef全文/Google Scholar
23. アレクサンダー氏、オーウェンズGK。 血管発達および疾患における平滑筋細胞分化および表現型スイッチングのエピジェネティック制御。 アニュ-レヴュー-フィジオール… (2012) 74:13–40. 土井:10.1146/アヌレフ-フィジオール-012110-142315
PubMed Abstract|CrossRef全文|Google Scholar
24. He C,Medley SC,Hu T,Hinsdale ME,Lupu F,Virmani R,et al. PDGFRbetaシグナル伝達は、局所炎症を調節し、アテローム性動脈硬化症を促進するために高コレステロール血症と相乗効果を発揮します。 ナット・コミュン (2015) 6:7770. doi:10.1038/ncomms8770
PubMed要約/CrossRef全文/Google Scholar
26. Da Ros F,Carnevale R,Cifelli G,Bizzotto D,Casaburo M,Perrotta M,et al. インターロイキン-1βを標的と破壊変換成長因子βシグナル伝達によって誘導される大動脈瘤から保護します。 イミュニティ… ら(2 0 1 7)4 7:9 5 9−7 3e9. 土井:10.1016/j.immuni.2017.10.016
CrossRef全文|Google Scholar
27. Hu D、Mohanta SK、Yin C、Peng L、Ma Z、Srikakulapu P、et al. 動脈三次リンパ器官は、大動脈免疫を制御し、血管平滑筋細胞リンホトキシンβ受容体を介してアテローム性動脈硬化症から保護する。 イミュニティ… (2015) 42:1100–15. 土井:10.1016/j.immuni.2015.05.015
PubMed要約/CrossRef全文/Google Scholar
29. Paramel Varghese G,Folkersen L,Strawbridge RJ,Halvorsen B,Yndestad A,Ranheim T,et al. ヒトアテローム性動脈硬化症におけるNLRP3インフラマソームの発現と活性化。 J Am Heart Assoc. (2 0 1 6)5:e0 0 3 0 3 1. ドイ:10.1161/ジャハ.115.003031
CrossRef全文/Google Scholar
30. de Jong RJ,Paulin N,Lemnitzer P,Viola JR,Winter C,Ferraro B,et al. アテローム性動脈硬化症を起こしやすいマウスにおける動脈新生内膜形成におけるアネキシンA1の保護適性-簡単な報告。 動脈硬化性血栓症 (2017) 37:312–5. 土井:10.1161/ATVBAHA.116.308744
CrossRef全文/Google Scholar
32. van Gils JM,Derby MC,Fernandes LR,Ramkhelawon B,Ray TD,Rayner KJ,et al. 神経免疫誘導キュー netrin-1は、プラークからのマクロファージの移住を阻害することにより、アテローム性動脈硬化症を促進する。 ナトゥール-イムノール (2012) 13:136–43. 土井:10.1038/ni.2205
CrossRef全文/Google Scholar
35. Tchkonia T,Zhu Y,van Deursen J,Campisi J,Kirkland JL. 細胞老化および老化分泌表現型:治療の機会。 J-クリニーク-インベストメント。 (2013) 123:966–72. doi:10.1172/JCI64098
PubMed要約/CrossRef全文/Google Scholar
37. Majesky MW,Horita H,Ostriker A,Lu S,Regan JN,Bagchi A,et al. 分化した平滑筋細胞は、Klf4によって調節された外膜における常駐血管前駆細胞の亜集団を生成する。 ら(2 0 1 7)1 2 0:2 9 6−3 1 1. 土井:10.1161/116.309322
PubMed要約/CrossRef全文/Google Scholar
40. Akhavanpoor M,Gleissner CA,Akhavanpoor H,Lasitschka F,Doesch AO,Katus HA,et al. ヒトアテローム性動脈硬化症における外膜三次リンパ器官分類。 カルディオバスコパル… (2018) 32:8–14. 土井:10.1016/j.carpath.2017.08.002
PubMed要約/CrossRef全文/Google Scholar
41. Moos MP,John N,Grabner R,Nossmann S,Gunther B,Vollandt R,et al. 外膜板は、標準的なチョウ給餌アポリポタンパク質E欠損マウスにおける免疫細胞蓄積の主要なサイトです。 動脈硬化性血栓症 (2005) 25:2386–91. 土井:10.1161/01.ATV。0000187470.31662.fe
Pubmed Abstract/CrossRef Full Text|Google Scholar
42. Mohanta SK,Yin C,Peng L,Srikakulapu P,Bontha V,Hu D,et al. 動脈の三次リンパ器官は高度のマウスのアテローム性動脈硬化の生得および適応性がある免疫応答に貢献します。 ら(2 0 1 4)1 1 4:1 7 7 2−8 7. 土井:10.1161/114.301137
PubMed要約/CrossRef全文/Google Scholar
43. Buettner M、Lochner M.小腸および結腸における二次および三次リンパ器官の発達および機能。 フロント-イムノール (2016) 7:342. 土井:10.3389/fimmu.2016.00342
PubMed要約/CrossRef全文/Google Scholar
45. Srikakulapu P、Hu D、Yin C、Mohanta SK、Bontha SV、Peng Lなど。 動脈三次リンパ器官は、高齢者ApoE-/-マウスにおける多層領土アテローム性動脈硬化症のB細胞応答を制御します。 動脈硬化性血栓症 (2016) 36:1174–85. 土井:10.1161/ATVBAHA.115.306983
CrossRef全文/Google Scholar
48. van de Pavert SA,Mebius RE. リンパ組織の発達に関する新しい洞察。 ナターシャ-レヴュー-イムノル。 (2010) 10:664–74. doi:10.1038/nri2832
CrossRef全文/Google Scholar
50. バローネF、ガードナー DH、ナヤールS、シュタインタールN、バックリー CD、ルーサー SA。 三次リンパ構造における間質線維芽細胞:慢性炎症における新規な標的。 フロント-イムノール (2016) 7:477. 土井:10.3389/fimmu.2016.00477
PubMed要約/CrossRef全文/Google Scholar
51. Scandella E,Bolinger B,Lattmann E,Miller S,Favre S,Littman DR,et al. リンパ組織誘導細胞とt細胞ゾーンの間質との相互作用によるリンパ器官の完全性の回復。 ナトゥール-イムノール (2008) 9:667–75. 土井:10.1038/ni.1605
PubMed Abstract/CrossRef Full Text|Google Scholar
52. Grandoch M,Feldmann K,Gothert JR,Dick LS,Homann S,Klatt C,et al. Deficiency in lymphotoxin beta receptor protects from atherosclerosis in apoE-deficient mice. Circ Res. (2015) 116:e57–68. doi: 10.1161/CIRCRESAHA.116.305723
PubMed Abstract | CrossRef Full Text | Google Scholar
53. Guedj K, Khallou-Laschet J, Clement M, Morvan M, Gaston AT, Fornasa G, et al. M1 macrophages act as LTbetaR-independent lymphoid tissue inducer cells during atherosclerosis-related lymphoid neogenesis. Cardiovascular research. (2014) 101:434–43. doi: 10.1093/cvr/cvt263
PubMed Abstract | CrossRef Full Text | Google Scholar