2020年10月26日、NCIスタッフによる
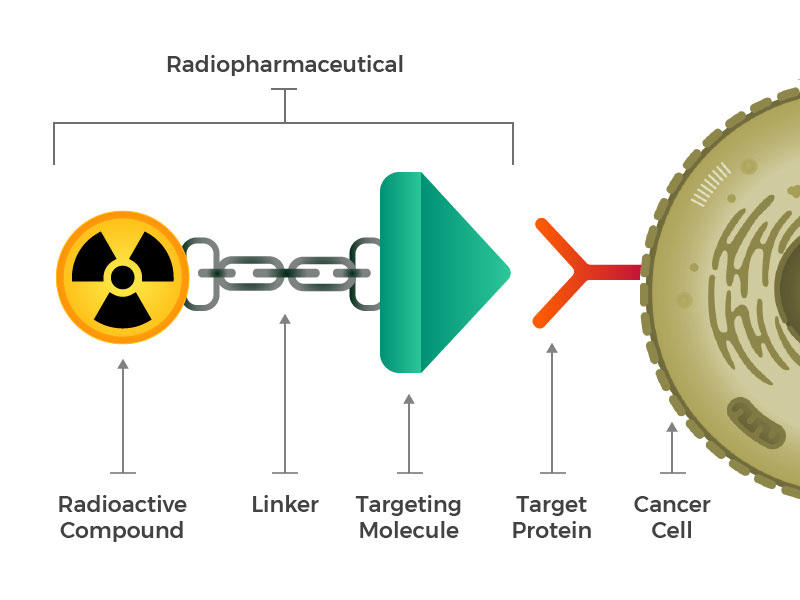
放射性医薬品は、放射性分子、標的分子、および両者を結合するリンカーで構成されています。
過去の二十年は多くのタイプの癌が扱われる方法の海の変更を持って来ました。 標的療法は、それらが成長、分裂、および広がりを助ける癌細胞内の特定のタンパク質をシャットダウンします。 免疫療法は癌と戦うのを助けるようにボディの免疫組織を刺激するか、または抑制します。 しかし、長年使用されている治療法—手術、化学療法、および放射線療法—は、ほとんどの癌の治療のバックボーンのままです。
放射線療法は、100年以上前にがんの治療に初めて使用されました。 すべての癌患者の約半分はまだ彼らの処置の間にある時点でそれを受け取ります。 そして最近まで、ほとんどの放射線療法は、100年前と同じように、体の中の腫瘍を殺すために体の外から放射線のビームを送達することによって、多くを与
効果はありますが、外部からの放射線も巻き添え被害を引き起こす可能性があります。 現代の放射線治療装置であっても、「腫瘍に到達するには正常な組織が必要です」と、Nciのがん治療評価プログラム(CTEP)のCharles Kunos博士は述べています。 放射線療法の結果として生じる副作用は、治療される身体の領域に依存するが、味の喪失、皮膚の変化、脱毛、下痢、および性的問題を含むことができる。
現在、研究者は放射線治療を癌細胞に直接かつ特異的に提供する放射性医薬品と呼ばれる新しいクラスの薬物を開発しています。 ここ数年は、新しい放射性医薬品を試験する研究と臨床試験の爆発を見てきました。
これらの研究は、細胞レベルでの放射線療法を標的とすることは、治療の短期および長期の副作用のリスクを低減すると同時に、癌細胞の小さな
「彼らは今後10年から15年の間に放射線腫瘍学を変革しようとしていると思う」とKunos博士は語った。
自然な親和性の上に構築する
細胞に直接放射線を送達することは、それ自体新しいアプローチではありません。 放射性ヨウ素と呼ばれるそのような治療法は、1940年代以来、いくつかのタイプの甲状腺癌を治療するために使用されてきました。ヨウ素は甲状腺細胞に自然に蓄積します。 元素の放射性バージョンは、実験室で生成することができます。 (丸薬か液体として)摂取されたとき、それは甲状腺剤の外科の後で残っている癌細胞を集め、殺します。
同様の天然親和性を利用して、骨に広がった癌を治療するための薬物、例えば二塩化ラジウム223(Xofigo)を開発し、2013年に転移性前立腺癌の治療に承認された。 癌細胞が骨で育つとき、破壊するために侵入する骨のティッシュを引き起こします。 ボディはそれからその骨—骨の転換と呼出されるプロセスを取り替えることによってこの損傷を修理するように試みます。
放射性元素ラジウムは”カルシウム分子のように見えるので、骨の回転率が最も高い体の領域に取り込まれます”とKunos博士は説明します。 ラジウムは、その後、近くの癌細胞を殺すことができます。
これらの放射性化合物はすべて、何の助けもなく癌細胞に移動します。 研究者らは、他の癌を特異的に標的とする新しい放射性分子を設計することが可能かどうか疑問に思った。
彼らは、放射性分子、標的分子(癌細胞に特異的に認識してラッチする)、および両者を結合するリンカーの三つの主要な構成要素からなる設計された放射性医薬品を想定していた。 そのような化合物は、注射、注入、吸入、または摂取され、その後、血流に入ることができる。
がん標的分子とがん細胞を殺す分子を結びつけるという考え方も新しいものではありません。 例えば、特定の癌細胞に結合する抗体が毒性薬物に結合する抗体−薬物複合体と呼ばれるいくつかの薬物が、癌を治療するために承認されている。
しかし、そのような薬物を作るための努力は限られた成功を収めている、とクノス博士は説明した、毒素が癌細胞に近づくだけでは不十分だからで 毒素は内部に取り込まれ、損傷を引き起こすのに十分な長さの細胞内に留まる必要があります。 多くの癌細胞が持っているか、それが起こることができる前に、単にすぐに戻って毒素をポンプするメカニズムを開発しています。
放射性医薬品は、薬物が細胞内に入ることができるときにも最も効果的です。 しかし、それは彼らが効果的であるために必要ではありません。 放射性医薬品が癌細胞に付着すると、放射性化合物は自然に分解する。 この崩壊は、近くの細胞のDNAに損傷を与えるエネルギーを放出する。 そして、細胞のDNAが回復不能に損傷すると、その細胞は死ぬ。 癌細胞は、放射線誘発性のDNA損傷に特に敏感である。
使用される放射性化合物の種類に応じて、得られるエネルギーは、放射性医薬品に結合した細胞およびその細胞を取り囲む約10-30個の細胞に浸透 これは、単一の放射性医薬品分子で死滅させることができる癌細胞の数を増加させる。
2010年代半ばまでに、食品医薬品局(FDA)は、血液癌の一種である非ホジキンリンパ腫の一部の人々を治療するために、特定のB細胞上の分子を標的とする2つの放射性医薬品を承認していた。 しかし、これらの薬は広く採用されたことはありませんでした。 リンパ腫患者を治療するいくつかの医師は、放射性化合物のこれらのタイプを投与するために訓練されました。 そして、放射性医薬品は、より新しい、非放射性医薬品との競争に直面しました。NCIの放射線研究プログラムのJacek Capala博士は、FDAが消化管に影響を及ぼす特定の癌性神経内分泌腫瘍(NETs)の治療のためにlutetium Lu177-dotatate(Lutathera)を承認した2018年に、この分野
「これは固形腫瘍もこの方法で標的にすることができることを示した」と彼は言った。 この場合、標的は、ネット細胞の表面に豊富に見られる特定のホルモン受容体である。
Lutetium Lu177-dotatateは、以前に試験されたどの薬剤よりも純成長を遅らせるのに優れていた、とケンタッキー大学のAman Chauhan博士は説明した。 “これは私たちの分野にとって大きな前進でした”と彼は言いました。
イメージング化合物からの薬物の適応
研究者は現在、黒色腫、肺癌、大腸癌、白血病などの多様な癌の範囲のための放射性医薬品を設計し、試験している、とCapala博士は述べている。 その細胞の表面に標的分子を有し、薬物を送達するのに十分な良好な血液供給を有する腫瘍は、放射性医薬品で治療される可能性がある、とChauhan博士は付
これらの新しい薬剤の多くは、核イメージングに使用される既存の化合物の再設計バージョンです。 陽電子放射断層撮影(PET)などの核画像検査では、がん細胞の表面上の特定の標的に結合する分子に結合した弱い放射性化合物を使用することがあ 特殊なカメラは、癌細胞の小さな沈着物さえも明らかにすることができ、体内の癌の広がりを測定するのに役立ちます。
研究者たちは現在、これらの標的分子を、より強力な放射性化合物、すなわち同位体を運ぶために再利用しています—単に可視化を助けるのではなく、癌細胞を死滅させる可能性のあるもの。
前立腺がんは、この再利用のための初期の試験場となっている。 PSMAと呼ばれるタンパク質は、前立腺細胞に大量に、そしてほぼ独占的に存在します。 PSMAに結合する分子をPETスキャンイメージングで使用される放射性化合物に融合させることにより、科学者たちは、従来のイメージングで検出するには小さ
PSMAを標的とするいくつかの放射性医薬品治療法が現在臨床試験で試験されています。
ほとんどの前立腺癌は放射線に非常に敏感であり、この疾患の治療には外部放射線が一般的に使用されている、とNCIの癌研究センターのFrank Lin、M.D.はnihクリニカルセンターでPSMAを標的とした放射性医薬品の臨床試験をリードしていると説明している。
初期治療として放射線を受けた男性のほとんどは、がんの再発を経験しません。 しかし、彼らが行う場合、それは時には多くの臓器に癌細胞の多くの小さな預金で、体全体に広がっている、と彼は説明しました。
「腫瘍がそのように広がったとき、外部放射線は一度にあなたの体の小さな部分に集中して治療することができるので、あなたは本当に外部線
PSMAを標的とする放射性医薬品を持つことは、血流に直接注入し、広く循環し、体全体に広がっている前立腺癌細胞に付着することができるため、このような場合に放射線を与えるためのより良い方法であると彼は説明した。
そして、同じ標的を使用するイメージング分子と治療分子を持つことの大きな利点は、イメージングが治療がうまくいく可能性があるかどうかを医師にこっそりプレビューすることができるということである、とリン博士は付け加えた。
例えば、リン博士の試験では、男性は治療前に化合物の画像化バージョンを用いたPETスキャンを受けなければならない。 イメージング化合物が癌細胞への道を見つけ、PETスキャンで検出された場合、研究者は対応する放射性医薬品治療がその標的に当たると仮定するこ
「この診断と薬物療法の補完的な開発は、この分野をはるかに刺激的にしている」とChauhan博士は語った。 「このようにして、私たちは腫瘍細胞に治療法を正しく提供していることを知ることができます。”
併用療法への移行
放射性医薬品は初期の研究で有望であることを示していますが、他のタイプの癌薬の場合と同様に、腫瘍を単独で一掃するこ
例えば、lutetium Lu177-dotatateは、治療後に神経内分泌腫瘍が縮小した人の数を倍増させましたが、その数はまだ控えめでした:約17%、薬物なしの7%から増加しました、とChauhan博士は説明しました。
「まだ改善の余地は大きい」と彼は語った。
放射性医薬品を他の治療法と組み合わせて使用することは、その改善を推進する一つの方法である可能性があります。 一部の研究者は現在、放射線増感剤と組み合わせた放射性医薬品を試験しています—癌細胞を放射線に対してさらに脆弱にする薬。 例えば、Chauhan博士は、放射線による損傷の後にDNA修復に必要な化合物を細胞が産生するのを阻止するtriapineと呼ばれる放射線増感剤と組み合わせたlutetium Lu177-dotatateの臨床試験をリードしています。
別の試験では、リン博士はLUTETIUM Lu177-dotatateをPARP阻害剤と呼ばれる一種の薬物で試験しています。 すでにいくつかの種類の乳癌、卵巣癌、および他の癌を治療するために承認されているこれらの薬物は、DNA修復自体のプロセスをブロックする。 「そのため、放射線はDNA損傷を引き起こし、PARP阻害剤は放射線後に腫瘍細胞がDNAを治癒するのを防ぐでしょう」と彼は説明した。
他の研究者は、放射性医薬品と免疫療法を組み合わせて、これらの薬剤の有効性を高めることを試みている。 「最近の研究では、放射性医薬品が腫瘍を免疫療法に反応させることができることが示されています」とCapala博士は述べています。
多くの腫瘍は”冷たい”腫瘍であり、免疫細胞はそれらを認識しないか、または腫瘍の周囲の微小環境で適切に機能しないという点で、彼は説明した。
しかし、放射線が癌細胞を死滅させると、それらの細胞からのタンパク質とDNAが血流に流出して免疫細胞が見ることができ、免疫細胞は体中の他の癌細胞を認識して死滅させる可能性がある。 放射線療法はまた、腫瘍の微小環境を免疫細胞に対してより親切にする可能性がある、とCapala博士は付け加えた。
これらの効果は一緒になって、冷たい腫瘍を「熱い」腫瘍に変えることができます:免疫細胞が豊富で、免疫療法薬に反応する可能性のある腫瘍。 いくつかの研究では、この種の応答を作成するために外部放射線を使用しようとしています。
「しかし、各腫瘍、各転移が放射線に曝されると、より効果的であることを示唆するデータがあります。 したがって、放射性医薬品療法には、体内に入るとすべての転移に達するという利点があります”とCapala博士は説明しました。
慎重な治療計画が全体的な安全な放射線量を確保できる限り、放射性医薬品と外部放射線を組み合わせることは理にかなっているかもしれない、と 「外部放射線療法は大きな腫瘍を標的とするのに非常に優れており、それを放射性医薬品療法と組み合わせて転移を標的とすることができます」と
課題と注意点
放射性医薬品の分野はまだ初期の段階にあります。 このアプローチがより広く使用される前に克服する必要がある一つの課題は、そのような薬物を投与するために訓練された医師の不足である。
「米国の核医学医師の数は少ない」と、核医学と腫瘍学の両方の訓練を受けているリン博士は述べている。 “そして、私たちは年に70人か80人の新しい人を訓練するだけだと思います。”
これまでのところ、この労働力不足は、放射性医薬品がパーソナライズされた治療としての真の可能性まで生きてきた、とCapala博士は説明しました。 その可能性は、他のタイプの癌薬とは異なり、医師はイメージングを使用して、放射性医薬品のどれだけが腫瘍に達したかをほぼリアルタイムで正確に測定し、それに応じて用量を調整することができるという事実を反映しています。
しかし、このタイプの治療計画には、広く利用可能ではない学際的な専門知識が必要であり、放射性医薬品を使用している人々を”放射性化学療法”とし 「これは、多くの患者が最適な治療を受けていないことを意味します」とCapala博士は述べています。
長期的な安全性研究も必要である、とChauhan博士は付け加えた。 外部放射線療法で治療された人々は、治療後数ヶ月または数年後に、後期効果と呼ばれるいくつかの副作用を経験することがあります。 これまでの研究では、放射性医薬品治療による後期効果の割合が高いことは示されていませんが、「これらは非常に新しい薬剤であり、引き続き慎重
Smoothing Collaborations
これらの薬物は比較的新しいものであるため、試験が進行中であっても、”放射性医薬品の医薬品開発の表面を傷つけているだけだ”とChauhan博士は述
2019年には、有望な新薬の臨床試験をさらに加速させるため、Nciは、有望な新薬の臨床試験への迅速化を目的とした放射性医薬品開発イニシアティブ(RDI)を立ち上げました。
NCIがRDIで達成したいことの一つは、他の方法では協力しないかもしれない異なる製薬会社によって生産された薬の組み合わせを使用して、より多くの試験を仲介することである、とイニシアチブをリードしているKunos博士は説明した。 知的財産と信頼の欠如についての懸念は、彼らが開始する前に、このようなプロジェクトを停止することができ、博士Kunosは説明しました。
「これらのタイプの協力は、NCIが中間の正直な仲介者でない限り、必ずしも起こらないだろう」と彼は言った。 現在、NCIが支援する初期段階の試験の約2%だけが放射性医薬品を試験していますが、RDIでは今後数年間で指数関数的に増加する可能性があります、と彼は付け加えました。
「我々は、放射線治療に使用する機械や他の技術を排除するつもりはない」とクノス博士は語った。 「しかし、その標的とされた性質により、放射性医薬品は放射線の使用方法を変革しようとしていると私たちは考えています。”