非アルコール性脂肪性肝炎患者のためのビタミンE治療
Jhonathan Ferney Vélez M.(1),Gustavo Amador Crespo H.(1),Juan Carlos Restrepo G.MD. Esp、修士号、博士号。 (2)
(1) コロンビアのメデジンにあるアンティオキア大学の医学部の医学生。
(2)アンティオキア大学の内科および胃疫学グループの准教授、コロンビアのメデジンのパブロ-トボン-ウリベ病院の肝臓学者。 [email protected]
受理:12-02-14受理:05-11-14
要約
非アルコール性脂肪性肝炎(NASH)は、組織学的に肝細胞のバルーニング、小葉炎症および脂肪症によって特徴付けられる。 この診断が疑われる場合は、肝障害の他の原因、特にアルコールの過剰消費を排除することが重要です。 それにもかかわらず、今日まで、生検は診断を確認するために利用可能な唯一の方法である。 ビタミンEは線維症の重要な影響がない時でさえ800UI/dayの線量がNASHに苦しんでいる非糖尿病性の大人の組織学を改善することを複数の臨床調査が示 これらの結果は生検によって確認された。 この薬剤の使用の証明された利点にもかかわらず、使用が食事療法および練習の変更を取り替えることができないが、むしろこれらの手段へ補足物
キーワード
非アルコール性脂肪性肝炎、ビタミンE、酸化ストレス。
はじめに
NASHは、組織学的に肝細胞のバルーニング、小葉の炎症および脂肪症によって特徴付けられる(1、2)。 現在、NASHは診断の金本位である肝生検によってのみ診断することができます。 また、患者の予後を確立するためにすべて重要である炎症、壊死および線維症の存在および程度に関する情報を提供する(2-5)。 NASHとアルコール性脂肪性肝炎の違いは顕微鏡的に小さく,組織学的に区別することは困難である。 このため、彼または彼女の飲酒習慣(についての患者からの情報を得ることが重要である4)。<5351><7258>NASHは、NAFLD(非アルコール性脂肪肝疾患)と呼ばれるより広範な実体の一部であり、これには肝脂肪症の初期段階:炎症のない脂肪症、および軽度の炎症を伴う脂肪症が含まれる。 最終的には、NAFLDは、線維症、最終的には肝硬変(に進行NASHの特徴的な炎症状態に開発しています1、2、5)。 個人が単純な脂肪症から炎症状態に進行することはまだ完全には明らかではない。 遺伝的感受性、代謝障害および酸化ストレスとの間の相互作用が最も重要な要因である(6、7)。NAFLDは世界的に最も流行している肝疾患である(2、4、6)。 NAFLDの有病率は20%から30%であると推定され、NASHの有病率は西洋世界の一般集団では2%から3%であると考えられている(8)。
その抗酸化特性のために、ビタミンEは現在のアメリカのNASH治療ガイドラインで推奨されています。 “800IU/日の毎日の線量で管理されるビタミンE(α-トコフェロール)はバイオプシー証明されたNASHの非糖尿病性の大人のレバー組織学を改善します”これはNASHの患者 この記事では、この病気の患者の治療におけるビタミンEの役割に重点を置いて、NASHの病態生理をレビューします。
病態生理
NASHの病因はまだ完全には明らかではありませんが、脂肪症とその後の脂肪性肝炎に至る事象を説明するためにこれまでに提案された最 この疾患の発症における最初のヒットは、脂肪過負荷(である11、12)。 坐った生活様式、遺伝の要因および高められたカロリーの取入口は脂肪組織から脂肪酸なしの肝臓の脂質の統合そして解放の増加をもたらすインシュリ 肝臓がこの状態に維持されると、それが生成し、循環から除去されるすべての脂肪酸を代謝することができなくなる。 この状態は、最終的には肝脂肪症と酸化ストレス(である第二のヒットにつながる4、5、13)。
酸化ストレスは、酸化防止剤よりも酸化促進剤を支持する不均衡である(3)。 肝脂肪症の間、肝細胞は、細胞小器官におけるフリーラジカルの産生の増加につながる代謝亢進状態に入る(13)。 肝細胞における活性酸素種(ROS)の増加量は、潜在的に壊滅的な効果(と追加のフリーラジカルの連続供給を提供する反応である脂質過酸化につながる14、15)。
抗酸化物質の一つはビタミンE(トコフェロール)であり、過酸化脂質と反応して脂肪酸に還元する。 それらは、細胞表面上のビタミンCとの反応を介してトコフェロールに戻るのに十分な長さ持続する比較的安定なラジカルトコフェロキシルを形成する(12)。 この機能のために、ビタミンEは、NASH(患者のための治療としての使用のために考慮されている13、16)。<5351><7258>NAFLDは、単純な脂肪症から脂肪性肝炎(NASH)に至る一般的な症候群であり、その後の線維症および肝硬変を伴う(5)。 診断時にはほとんどの患者は無症候性であるが、一部の患者、特に子供は疲労および不快感を訴えることがある。 腹部の右上腹部の不快感、アミノトランスフェラーゼのレベルの上昇による疑い、および明るい肝疾患を伴う腹部超音波は、すべてこの疾患の徴候であ 肥満、糖尿病および脂質異常症は、NAFLDおよびNASHに関連する可能性のある状態の評価中にも考慮されるべきである(5、17)。
診断評価の際には、肝疾患の他の一般的な原因を除外すべきであるが、最終的には肝生検が診断を確認するために利用可能な唯一の方法である。 また、患者の予後を決定するためにも重要である(表1)(3、4)。 その大きな臨床的価値にもかかわらず、生検は高価であり、罹患率のわずかな増加をもたらし、まれに死亡率をもたらす。 このツールは、脂肪性肝炎および高度な線維症(肥満、II型糖尿病、脂質異常症および代謝症候群)のリスクが高い非アルコール性肝脂肪症の存在が疑われ、診断が不確実な場合にのみ考慮されるべきである(3、9)。

非アルコール性脂肪性肝炎の治療におけるビタミンEの役割
現在、NASHの有効な治療法はありません。 それにもかかわらず、抗酸化因子としてのビタミンEの重要な役割を考慮すると、この疾患の臨床的および病理組織学的進化におけるその利点を
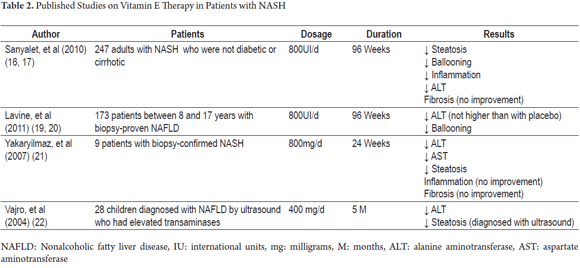
これらの中には、PIVENS試験(非アルコール性脂肪性肝炎を有する非糖尿病患者の治療のためのピオグリタゾン対ビタミンE対プラセボ)がある。 これは、NASHを有する247人の非糖尿病患者および非硬変患者において組織学的改善が評価された多施設、二重盲検、プラセボ対照試験であった。 患者は、ピオグリタゾン(80人の患者)、ビタミンE(84人の患者)またはプラセボ(83人の患者)の一日用量を96週間(18)受けるためにランダムに割り当てられた。 毎日の適量はピオグリタゾンのための30mgおよびビタミンEのための800U.この調査はピオグリタゾン(p=0.001)を受け取った患者の43%がピオグリタゾン(p=0.04)を受けた人の34%およびplacebosを受け取った人の19%対改善したことが分った。 ピオグリタゾンとプラセボの改善率の差は統計的に有意ではなかったが,ビタミンEとプラセボの改善率の差は統計的に有意ではなかった。 それにもかかわらず、両方の薬物は、アミノトランスフェラーゼレベルの改善、脂肪症および小葉炎症の減少と関連していたが、どちらも線維症の改善をも 同じ研究では、ビタミンEでの治療後にアミノトランスフェラーゼレベルが増加し、治療の無期限の投与が必要である可能性があることを示す懸濁さ さらに、ビタミンEの有害作用とプラセボの有害作用との間に有意差は認められなかった(19)。
HoofnagleらによるPIVENS裁判の再評価。 ビタミンEまたはプラセボを受けた患者における血清ALTの応答と、この応答と初期の臨床的、組織学的変化および体重の変化との相互作用との関連 彼らは、ALTの変化がプラセボを受けた人よりもビタミンEを受けた人(48%)の間でより一般的であることを発見した(16%;p<0.001)。 ビタミンEを投与された群の中で、ALT応答は非アルコール性脂肪肝疾患(NAFLD)の活性低下と関連していたが、96週の治療終了後の線維症の改善はなかった。 投与終了後のビタミンE群ではALT値は増加したが,投与終了後のプラセボ群では増加しなかった。 両方の治療群は、120週目にほぼ同一のALTレベルを有していた。 これらの結果は、PIVENS試験の主な出版物の完全なコホートに示されている結果と同様である。 さらに、結果は、体重減少(2kg以上)もALT応答と関連し、NAFLDの改善(<0.001)および線維症の改善(p<0.02)を示したが、ビタミンEは体重の変化とは無関係にNAFLDに 最後に、ALT応答および組織学に対するビタミンEおよび体重減少の影響は独立していることに留意すべきであり、体重を減らす患者でさえ、ビタミ
トニック(小児における非アルコール性脂肪肝疾患の治療)試験は、別の多施設、二重盲検、プラセボ対照試験であった。 これには、八歳から十七歳の間にあった173人の患者が含まれていました。 患者は、ビタミンE(58患者)、メトホルミン(57患者)またはプラセボ(58患者)を96週間投与するためにランダムに割り当てられた。 投与量は、ビタミンEのために一日二回400IUとメトホルミンのために一日二回500mgであった(21)。 いずれの薬剤も、ベースラインALTレベルで少なくとも50%の持続的な減少または40U/L以下の持続的なALTレベルを達成するためにplacebosより優れていなかった。 測定は、第48週から第96週まで12週ごとに行った。 この研究はまた、NASHの分解能がプラセボ群よりもビタミンEで治療された患者群で有意に高かったことを見出した。 この結果は、ビタミンEで治療された患者で発見された肝細胞バルーニングの有意な減少に起因していた。 これはPIVENSの結果に類似していますが、TONIC試験では、小児患者と成人のNALFDの病理組織学的差異のために、肝細胞バルーニングの減少を主要な結果として見ていませんでした。 強壮性研究では、線維症の改善は見られなかった(22)。
これら2つの大規模な研究の前に、評価された主要な成果に大きな違いがある結果を持つ他の小規模な研究がありました。 はるかに小さい集団に加えて、これらの研究はより少ない監視時間を有し、そのうちのいくつかはプラセボ群で制御されなかった。
Yakaryilmazらによる2007年の研究。 生検でNASHの診断が確認された9人の患者に対するビタミンEの影響を調べた。 ビタミンEがペルオキシソーム増殖剤活性化受容体ガンマ(PPARG)およびインスリン抵抗性に及ぼす影響を評価した。 患者はビタミンEの800mgを24週間毎日与えました。 治療が開始される前に、患者の肝臓は生化学的および組織学的に評価された。 これらの評価は、治療が終了した後に繰り返された。 24週の終わりに、AST、ALTおよび脂肪症の統計的に有意な減少が見出されたが、炎症および線維症のレベルに組織学的変化は見出されなかった。 患者はビタミンEのこの投与量で副作用を経験しませんでした(23)。
Vajro,et al. (2004)は、肥満関連肝機能障害を有する28人の子供のグループの研究を実施した。 患者は二つのグループに分けられた。 一つのグループの平均年齢は9.88(+/-3.97)年であり、二つのグループの10.7(+/-3.45)であった。 患者は、超音波によって測定された体重減少、トランスアミナーゼレベルおよび脂肪症に対するビタミンE治療の有益な効果があったかどうかを決 この研究に含まれている子供たちはすべて、慢性高トランスアミナーゼ血症(ASTまたはALTレベルが正常値の1.5倍以上6ヶ月間)および超音波における脂肪症の徴候を有していた。 この研究では、患者をグループ1(プラセボプラス食)とグループ2(ビタミンE+食)のいずれかのグループに無作為化する単一盲検デザインが行われました。 その後、各グループは、治療の患者の遵守に応じて細分化された。 グループ1は、国会に準拠している人のためのサブグループ1Aと、遵守していない人のためのサブグループ1Bに分かれていました。 グループ2は、ビタミンE療法を遵守していた人のためのサブグループ2AとビタミンE療法を遵守していなかった人のためのサブグループ2Bに分 サブグループ2Aは、さらに、国会に準拠していない人のためのサブグループ2A1と国会に準拠していた人のためのサブグループ2A2に分割されました。 この研究では、400mg/日のビタミンE投与量が、体重の変化とは無関係に正常化に近づいたサブグループ2Aの患者のALT値の有意な減少を生じたことが分 一方、ビタミンEの高い血清レベルを達成し、また体重を失った患者は、ALTの正常化および脂肪症の寛解を達成した。 さらに、食事のみを遵守したサブグループ1AとビタミンE療法のみを遵守したサブグループ2a1との比較では、両方のグループの患者は、モニタリングの二ヶ月でALTのレベルを低下させたが、モニタリングの五ヶ月でサブグループ1A(食事のみを遵守した)よりもサブグループ2A1(ビタミンEのみを遵守した)よりも大きな減少があったことが分かった。 脂肪症のすべての徴候は、ビタミンEの400mgの治療中に体重を失ったサブグループ2A2グループの超音波画像から消失した。 これらの結果は、NASH患者の主要な治療介入の一つとして健康的な食事を促進することの重要性を強調しているが、多くの患者が介入の失敗につながる食 これは、これらの患者(のための良い代替療法として、このようなビタミンEなどの抗酸化物質を使用することの重要性を強調24)。
Kugelmasらによるパイロット研究。 (2003)は、サイトカイン(TNF α、IL-8、IL-6)のプロファイルと生検で証明されたNASHと16歳の18と65歳の間の患者における肝酵素のレベルに対するビタミンEの毎日の投与の有無にかかわらず、有酸素運動の増加と組み合わせたアメリカ心臓協会の食事のステップ1の効果を評価しました。 これは、患者が無作為に毎日800IUのビタミンEを受け取るように割り当てられた単一盲検試験でした。 ビタミンEを受け取らなかった患者はplacebosを受け取った。 テストは12週の期間にわたって遂行されました。 サイトカイン値は、研究中にビタミンEの投与の有無にかかわらず体重減少で有意に減少しなかった。 ライフスタイルの変化は、nash患者の肝臓酵素および血漿コレステロールの改善と関連していたが、本研究で使用されたビタミンEの投与量は追加の この結果は、小さなサンプルサイズ、短いフォローアップ時間、または使用されるビタミンEの投与量に起因する可能性があります(25、26)。
2013年に発表されたNASH患者の治療のための現在利用可能な選択肢についてのレビューでは、肝硬変ではなく、糖尿病を持たない生検によって確認されたnash患者の第一選択療法としてのビタミンEの使用に関する現在の勧告を認識したが、この療法が患者の半分未満で有意な利益を示しているという事実を強調した。 このため、このレビューでは、NASH患者に対する効果的な治療法が開発される場合、将来の治療戦略は病原性疾患経路に基づくべきであると結論付けた(27)。
Ji H-F et al. NAFLD、NASHおよび慢性c型肝炎(CHC)患者におけるアミノトランスフェラーゼの減少に対するビタミンEの効果を評価するためのメタ分析を実施した。 彼らが見た4つの研究には、ビタミンEサプリメントを受けたNASH患者が含まれていました。 この研究には、TONICとPIVENSの試験が含まれていました。 彼らは、ビタミンEがこれらの患者のASTとALTのレベルを最適化できることを発見しました。 しかし、このメタアナリシスは、生活習慣の変化、運動および他の抗酸化物質の使用を含む介入の影響を排除することができないこと、およびアルコールおよび薬物使用などの慢性肝疾患に対する他の危険因子の影響を排除することができないことによって制限されていたことに留意すべきであり、これに加えて、肝臓疾患の診断および評価時に採取された生検よりも全体的な分析を制限するだけでなく、アミノトランスフェラーゼレベルに対する特異性が低いため、研究の異質性を考慮する必要がある(28)。
NASH患者におけるビタミンEの使用の効果を評価するための主要な研究の中で、プラセボおよび他の治療選択肢の使用と短期的に統計的に有意な差
脳血管障害の全発生率および脳血管障害のサブタイプに対するビタミンEの影響を少なくとも一年間評価するために、無作為化された新しい無作為化プラセボ対照試験を含む9件の系統的レビューが行われた。 出血性脳卒中のリスクが増加していることがわかった(RR=1.22、95%CI:1.0~1.48、p=0.045)。 彼らのレビューから得られた結果のために、研究者は、罹患率および死亡率における出血性脳卒中の重大な結果のために、ビタミンEの無差別な使用
35,533人の患者を含む無作為化プラセボ対照研究では、前立腺癌に関連するビタミンEのリスクが研究されています。 それは400IUの毎日の線量でビタミンEを受け取っているグループと偽薬のグループを比較しました。 ビタミンEを摂取した人の間で前立腺がんのリスクが有意に増加した(HR1.17;99%CI、1.004-1.360;p=0.008)。 リスクの絶対的な増加は1000人年あたり1.6でした(30)。
別のメタアナリシスでは、成人のビタミンE補給と総死亡率の用量反応関係を調べています。 高用量のビタミンE(400IU/日以上)を摂取した患者は、すべての原因による死亡率が増加していることが示されました。 このメタアナリシスは、ビタミンE単独または他のビタミンまたはミネラルとの組み合わせで治療を受け、妊娠中の女性を除外し、治療とモニタリングの最低1年を持っていた成人で構成された患者サンプルを無作為化比較試験にその検索を制限しました。 このメタ分析によって提供された結果は、いくつかの研究のサンプルサイズが小さく、いくつかの慢性疾患を有する患者の間で行われたため、注意して考慮されるべきである。 これは、健康な成人集団(に結果を一般化するための研究の能力を制限する31)。
結論
現在、NASH患者に有効な薬物療法はありませんが、PIVENS研究によって示された証拠は、ビタミンEの適切な投与が糖尿病を持たないnashの成人非硬変患者の肝組織学を改善することを示唆している。 それにもかかわらず、この勧告が糖尿病患者またはnashを伴う肝硬変を有する患者に拡張される前に、より多くの研究が必要である。 NASHの小児科の患者で行なわれた調査はビタミンEの管理に加えてビタミンeの使用を支える十分な証拠を見つけませんでした、減量が脂肪症およ 身体活動の増加と組み合わせた低カロリー食による体重減少は、すべての患者に推奨されるべきである。 副作用に関しては、プラセボおよび他の治療選択肢を用いたビタミンEの短期使用において統計的に有意な差は見出されていない。 それでも、ビタミンEの無差別な使用は前立腺癌、出血性の打撃およびすべての原因からの死の高められた危険を提案する証拠があるので長い一定期間のために推薦されません。
1. Abbas AK,Fausto N.Hígado,vesícula biliar y vías biliares. Ja:Robbins SL,Mitchell RN,Kumar V,Abbas AK,Fausto N.Patología funcional y estructural. 8va Ed. バルセロナ:エルゼビア、2012年。 645-687頁
2. Brunt E,Neuschwander-Tetri B,Burt AD. 脂肪肝疾患:アルコール性および非アルコール性。 Ja:バートAD、フェレル、LポートマンBC。 マクスウィーンの肝臓の病理。 第6版。 英国:エルサービエ;2012。 293-359頁
3. コラードRL、トーレスDM、ハリソンSA。 非アルコール性脂肪肝疾患の治療選択肢のレビュー。 Med Clin N Am2014;98:55-72.
4. Koek GH,Liedorp PR,靭皮A.非アルコール性脂肪性肝炎における酸化ストレスの役割. Clinica Chimica Acta2011;412:1297-1305.
5. コルテス=ピントH、エルメリンダ-カミロM. 非アルコール性脂肪肝疾患/非アルコール性脂肪性肝炎(NAFLD/NASH):診断と臨床経過。 ベストプラクティス&研究臨床胃腸病2004;18(6):1089-104.
6. Mishra A,Younossi ZM. 非アルコール性脂肪肝疾患の疫学と自然史。 臨床および実験肝臓学のジャーナル2012;2(2):135-44.
7. ロロAP、テオドロJS、パルメイラCM。 非アルコール性脂肪性肝炎の病因における酸化ストレスの役割。 自由なRadic Biol Med2012;52(1):59-69.
8. マチャドMV,コルテス-ピントH. 非アルコール性脂肪肝疾患の非侵襲的診断。 重要な評価。 肝臓学のジャーナル2013;58(5):1007-19.
9. Chalasani N,et al. 非アルコール性脂肪肝疾患の診断と管理:肝疾患の研究のためのアメリカ協会、胃腸病のアメリカの大学、およびアメリカ消化器学会による実践ガイ 2012年(平成24年)5月5日に廃止された。
10. Mazzella N、Ricciardi LR、Mazzotti A、Marchesini G.NAFLD患者の管理のための薬物療法の役割。 Clin肝臓Dis2014;18:73-89.
11. Chunga MY,Yeunga SF,Parka HJ,Volekb JS,Brunoa RS. 食餌療法のα-およびγ-トコフェロールの補足は非アルコール性脂肪性肝炎の肥満のマウスモデルのリポ多糖誘発の酸化圧力そして炎症性関連の応答 栄養生化学のジャーナル2010;21:1200-1206。
12. 日CP、のジェームズ。 脂肪肝炎:二つの”ヒット”の物語? Gastroenterology1998;114:842-4.
13. ハーパー-ハ、マレー-RK、ロッドウェル-VW、ベンダー-ダ。 Bioquímica ilustrada,28ed. 2010年、”マグロウヒル-インターアメリカーナ”でメジャーデビュー。 484-485頁
14. Neuschwander-Tetri BA. 肝脂肪毒性および非アルコール性脂肪性肝炎の病因:非トリグリセリド脂肪酸代謝産物の中心的役割。 肝臓学2010;52(2):774-88.
15. Le T,Loomba R.非アルコール性脂肪肝疾患および脂肪性肝炎の管理. 臨床および実験肝臓学のジャーナル2012;2:156-173。
16. Verdam FJ,Dallinga JW,Driessen,de Jonge C,Moonen E,van Berkel J,Luijk J,Bouvy ND,Buurman AW,Rensen SS,Greve JW. 非アルコール性脂肪性肝炎:呼気の分析による非侵襲的診断。 肝臓学のジャーナル2013;58:543-548.
17. Palmentieri B,de Sio I,La Mura V,et al. 肝脂肪症の診断における超音波B-mod検査における明るい肝エコーパターンの役割。 Dig肝臓Dis2006;38:485-9.
18. Sanyal AJ,et al. 非アルコール性脂肪性肝炎を有する非糖尿病患者の治療のためのピオグリタゾン対ビタミンE対プラセボ:PIVENS試験デザイン。 2009;30(1):88-96.
19. Sanyal AJ,Chalasani N,Kowdley KV,McCullough A,Diehl AM,Bass NM,et al. 非アルコール性脂肪性肝炎のためのピオグリタゾン、ビタミンE、またはプラセボ。 N Engl J Med2010;362(18):1675-85.
20. Hoofnagle JH,Van Natta ML,Kleiner DE,Clark JM,Kowdley KV,Loomba R,et al. ビタミンEおよび非アルコール性脂肪性肝炎患者における血清アラニンアミノトランスフェラーゼレベルの変化。 Aliment Pharmacol Ther2013;38(2):134-43.
21. Lavine JE,Schwimmer JB,Molleston JP,Scheimann AO,Murray KF,Abrams SH,et al. 小児における非アルコール性脂肪肝疾患の治療:トニックトライアルデザイン。 2010;31(1):62-70.
22. Lavine JE,Schwimmer JB,Van Natta ML,et al. 小児および青年における非アルコール性脂肪肝疾患の治療のためのビタミンeまたはメトホルミンの効果:トニック無作為化比較試験。 JAMA2011;305(16):1659-68.
23. Yakaryilmaz F,Guliter S,Savas B,Erdem O,Ersoy R,Erden E,et al. 非アルコール性脂肪性肝炎患者におけるペルオキシソーム増殖因子活性化受容体-α発現およびインスリン抵抗性に対するビタミンE治療の効果:パイロット研究の結果。 インターンMed J2007;37(4):229-35.
24. Vajro P,Mandato C,Franzese A,Ciccimarra E,Lucariello S,Savoia M,et al. 小児肥満関連肝疾患におけるビタミンE治療:無作為化研究。 J小児科-胃腸科-消化器科-消化器科-消化器科-小児科2004; 38(1): 48-55
25. Papastergiou V,et al. アルコール性肝炎における短期死亡率のための九つのスコアリングモデル:生検で証明されたコホートにおける交差検証。 Aliment Pharmacol Ther2014;39:721-732。
26. Kugelmas M,Hill DB,Vivian B,Marsano L,McClain CJ. サイトカインとNASH:ライフスタイルの変更とビタミンEの影響のパイロット研究。
27. Younossi ZM、Reyes MJ、Mishra MA、Mehta R、Henry L.メタ分析による系統的レビュー:非アルコール性脂肪性肝炎-病原性標的に基づくパーソナライズされた治療のための症例。 アリメントPharmacol Ther2014;39:3-14.
28. Ji HF,et al. NAFLD、NASH、およびCHC患者におけるアミノトランスフェラーゼレベルに対するビタミンE補給の影響:メタ分析からの結果。 2014年1月6日にavex traxから発売された。
29. Markus S、Robert JG、Pamela MR、Christophe T、Tobias K.脳卒中サブタイプに対するビタミンEの影響:ランダム化比較試験のメタ分析。 BMJ2010;341.
30. Klein EA,Thompson IM,Tangen CM,et al. ビタミンeと前立腺がんのリスク:セレンとビタミンeがん予防試験(選択)。 JAMA2011;306(14):1549-56.
31. Miller ER,3rd,Pastor-Barriuso R,Dalal D,Riemersma RA,Appel LJ,Guallar E.メタアナリシス:高用量のビタミンE補給は、全原因死亡率を増加させる可能性がある。 Ann Intern Med2005;142(1):37-46.