イオン性電解質
水と他の極性分子は、図\(\PageIndex{2}\)に示すように、イオンに引き寄せられます。 イオンと双極子を持つ分子との間の静電引力は、イオン-双極子引力と呼ばれる。 これらのアトラクションは、水中でのイオン性化合物の溶解に重要な役割を果たしています。
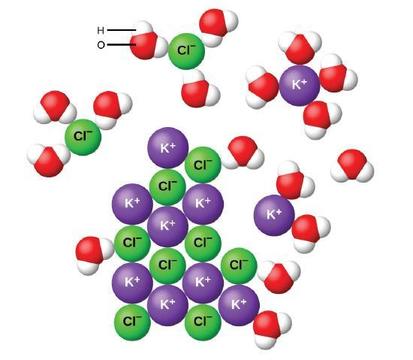
イオン性化合物が水に溶解すると、固体中のイオンが分離し、水分子がイオンを取り囲んで溶媒和するため、溶液全体に均一に分散し、それらの間の強い静電力を減少させる。 このプロセスは、解離として知られている物理的な変化を表します。 ほとんどの条件下では、イオン性化合物は溶解するとほぼ完全に解離するため、強力な電解質として分類されます。
固体のKClを水に加えると微視的なレベルで何が起こるかを考えてみましょう。 イオン双極子力は、極性水分子の正の(水素)端を固体の表面の負の塩化物イオンに引き付け、負の(酸素)端を正のカリウムイオンに引き付ける。 水分子は個々のK+とCl−イオンの間に浸透し、それらを囲み、イオンを一緒に結合する強いイオン間力を減少させ、図が示すように溶媒和されたイオンとし 静電引力の減少は希薄溶液中の各水和イオンの独立した運動を可能にし,イオンが結晶中の固定位置と秩序位置から溶液中の移動状態とはるかに無秩序な状態に変化するにつれて系の無秩序性が増加する。 この増加した無秩序は熱の吸収と分解するKClを含む多くのイオンの混合物の分解に責任があります。
他のケースでは、結晶中のイオン間の静電引力が非常に大きいか、イオンと水分子間のイオン双極子引力が非常に弱いため、無秩序の増加はイオンを分離するために必要なエネルギーを補うことができず、結晶は不溶性である。 このような炭酸カルシウム(石灰石)、リン酸カルシウム(骨の無機成分)、および酸化鉄(錆)などの化合物の場合である。