Protocols
Hybridoma Production
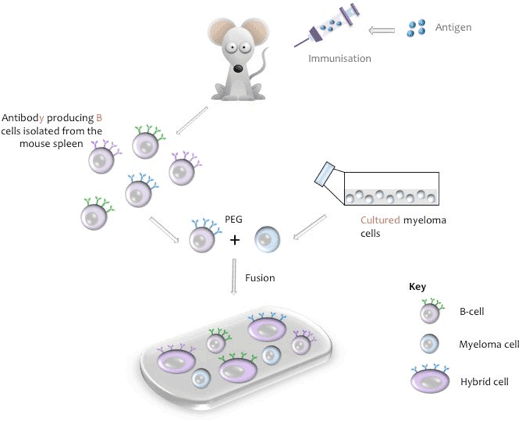
hybridomaは、培養中に抗原の一つのエピトープに特異的なモノクローナル抗体を永久に分泌することができる一つのハイブリッド細胞から生 このハイブリッド細胞は、免疫動物(通常、マウス、ラット、またはウサギ)からの特異的抗体産生B細胞と、「不死」培養骨髄腫細胞株(例えば、マウスNS−1またはns−0)からの細胞との融合を介して産生される。
マウスハイブリッド細胞の産生
融合プロセス中に、マウス脾臓からB細胞を単離し、マウス骨髄腫細胞株と混合し、ポリエチレングリコール(PEG、付録I参照) (関連する骨髄腫系統は、他の動物種由来のB細胞が使用される場合に使用される)。 得られたハイブリドーマは、ヒポキサチン、アミノプテリン、チミジン(HAT)、他の弱いハイブリドーマ細胞を上回る可能性がある任意の融合していない骨髄腫細胞を死滅させるステップを含む組織培養培地中で培養されます。 未融合のB細胞は分裂の力が限られており、培養中に自然に死滅する。 融合プロセスの1 0日後に、培養上清を回収し、所望の抗体の存在について試験する。
細胞融合の模式図
- 細胞(層流またはクラスIIキャビネット)を調製および処理するための滅菌環境
- インキュベーターを37℃に設定し、5%のCO2および湿度95%
- 倒立顕微鏡
- 37℃の水バスをキャビネットに置くことができる
- >スイングアウトローターを備えた遠心分離機
- 滅菌解剖器具-理想的には二組のはさみと鉗子(湾曲したものと鈍いものが終わったもの)で構成されています。
- 75ml組織コーニング培養フラスコ–Ref. 15430641
- 24ウェルファルコンプレート-Ref. 353047
- 滅菌ピペット
- ピペットフィラー
- 滅菌パスツールピペット
- タイマー
培地およびその他の試薬(詳細は付録Aを参照)
- RPMI1 6 4 0重炭酸塩緩衝液、L−グルタミン(Lonza Ref. BE12-702F)
- rpmi1640Hepes緩衝液、L-グルタミンなし
- 良質(バッチテスト済み)胎児ウシ血清(Genycell Ref. GCS0101-500)
- ペニシリン/ストレプトマイシン(Gibco Ref. 15070-063)
- Ultroser G(Pall Ref. 15950-017)
- HAT(Hypoxathine,Aminopterin,Thymidine)(Gibco Ref. 21060-017)
- PEG1500(Roche Ref. 10783641001)
開始する前に(詳細については付録Aを参照してください)
- A500mlを作る
- 培地A500mlを作る+
- 培地B100mlを作る
- 培地C100mlを作る
- 培地D500mlを作る
骨髄腫細胞の解凍と増殖
骨髄腫細胞株を解凍し、培地A中で増殖させる。 骨髄腫細胞株を解凍して培養するには、以下の方法を使用します。
- 凍結した骨髄腫細胞のバイアルをLN2保管庫から取り出します。
- 細胞を37℃の水浴に入れます。
- 汚染の可能性を減らすために、凍結バイアルの蓋を水の表面の上に置いてください。
- 細胞がほぼ解凍されると(氷の少しの塊だけが残る)組織培養フードに移動します。
- バイアルの外側を70%エタノールで拭き取り、上部を取り外します。
- 滅菌パスツールピペットを使用して細胞懸濁液を慎重に除去します。<6864><5081>内容物を10mlの培地Aを含む遠心分離機管に移します(付録A参照)<6864><5081>細胞懸濁液を300gで5分間静かに回転させます。
- 上清を除去し、10mlの新鮮な培地Aに細胞を再懸濁し、小さな(25cm2)フラスコに入れます。
- 元のフラスコから1mlの懸濁液を取り出し、9mlの培地Aで第二の懸濁液に加えます。
- フラスコをCO2インキュベーターに入れます。 ガス状の交換を可能にするために、フラスコの蓋をわずかに開いたままにすることを忘れないでください。
融合プロセス
三日前-融合のための骨髄腫細胞を準備する
骨髄腫細胞は、あなたがそれらを使用するときに指数関数的な成長期にある必 ただし、骨髄腫細胞の75cm2フラスコを2枚、1:40の希釈で1枚、1:60(下記参照)でセットアップする場合は、融合の3日前にフラスコの1枚が融合の日に理想的でなければなりません。 (最初にここに与えられたものの上下の希釈で追加のフラスコを設定すると、その後の融合のための骨髄腫細胞の増殖速度を必要な裁判官の経験を提供する必要があります)。
一日前-培地
を準備し、37℃に予熱する必要があります(インキュベーターに一晩置くことができます)。
- 2x200mlの培地A+に75cm2フラスコ
- 100mlの培地B
- 100mlの培地C
- 1x4ml PEG1500を箔に転写してラップした(PEGは光に敏感である)滅菌ユニバーサル
- ミニwaterbathは、200mlの蒸留水を約100Ml含むビーカーから作られ、50mlのファルコンチューブを直立させるための開口部があるように十分な幅のテープで交差させた
融合の日
- マウスを殺し(制度的ガイドラインに従って)、脾臓を抽出し、5MLの蒸留水を含む滅菌容器に入れた。 媒体C.
- 後続のすべてのステップは層流フードで実行する必要があります。
- 脾臓と培地をペトリ皿に入れる。
- 脾臓を滅菌鉗子で動かして洗浄する。 癒着を除去し、脾臓を第二のペトリ皿に移す
- 脾臓を二つに切断する。 鈍い鉗子で半分を保持し、湾曲した鉗子の別のペアを使用して、静かにできるだけ多くの細胞を除去するように注意して、脾臓カプセルから細胞をいじめる。 脾臓の後半を使用して繰り返す
- 脾臓のカプセルの破片を取り除き、滅菌パスツールのピペットを使用して、細胞をよくしかし非常に穏やかに混合する。
- 細胞懸濁液を15mlのチューブに移し、さらに5mlの培地Cを使用してペトリ皿をすすぎ、チューブ内の脾臓細胞に加えます。
- 骨髄腫と脾臓の細胞を数えます。
- 1つの骨髄腫細胞と10つの脾臓細胞の比率が必要です
- 骨髄腫細胞を50mlの円錐形のチューブに追加します。<6864><5081>脾臓細胞(15ml管)と骨髄腫細胞(50ml管)の両方を300gで10分間遠心分離する。
- 非常に慎重に両方のチューブの上澄みを注ぎ、10mlの培地Bにそれぞれペレットを静かに再懸濁します。fbsが存在すると細胞が融合しないため、融合プロセ)
- 1つの50ml遠心分離機管にresuspended脾臓の細胞および骨髄腫の餌を結合して下さい。
- 300gで5分間遠心分離する。
- 上澄みをできるだけ慎重に注ぎます。
- ベンチのチューブをそっと叩いてペレットを再懸濁させる。 これが溶解のために利用できる細胞数を減らす管のまわりで細胞を配るので餌を打たないか、またはピペットをそれはピペットしないで下さい。
- チューブを自家製の水浴に入れます。
- 1.2mlのPEG drop by dropを数滴ごとに静かに攪拌しながら、一分間にわたって滴下する。
- 培地B1mlを加え、数滴ごとに静かに攪拌します。
- さらに2mlの培地Bを加え、数滴ごとに穏やかに攪拌する。
- さらに4mlの培地Bを加え、数滴ごとに穏やかに攪拌する。
- 時間の終わりに、培地Cの8mlを追加します。
- 細胞のチューブを5分間300g遠心分離機。
- 非常に慎重に上清をデカントし、培地A+の10mlで1分間細胞ペ これを行うには、ペレットを分割するために開始するために培地の数mlを追加します。 細胞のこれらの塊を非常に静かに吸い上げ、ピペットの中で上下に移動します。 これらの細胞を追放し、プロセスを繰り返す。 非常に穏やかで、離れてペレットを強制しないでください、あなたは終了したときに細胞の小さな塊を持っているかもしれません。 細胞はこの段階で非常に壊れやすいです。
- 再懸濁された融合の組合せの10mlを暖かい媒体Aの190mlに入れて下さい+
- 最終的な容積は200mlです
- 8×24の井戸(2ml)の版の各井戸にこの懸濁液の1ml (合計192ウェル)
- プレートをインキュベーターに一晩(約24時間)放置する。
融合の翌日
- 8mlのHATを200mlの培地A+に加えます。
- この選択培地1mlを8枚のプレートの各ウェルに入れます。
- プレートはインキュベーターに入れておきます。 コロニーは7から10日の間に現われます

付録I
培養培地A:
Rpmi1640培地にL-グルタミン(重炭酸塩緩衝液)を添加したもの(Lonza Ref. BE1 2−7 0 2F)<1 5 7 0>+1 0%FBS(Genycell Ref. GCS0101-500)
+ペニシリン(100U/ml)/ストレプトマイシン(100mg/l)(Gibco Ref. 15070-063)
培地A+:
RPMI 1640 medium with L-Glutamine (bicarbonate buffered) (Lonza Ref. BE12-702F)
+10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
+ Ultroser G (1%) (Pall Ref. 15950-017)
Culture Medium B (no FBS):
RPMI 1640 Medium with L-Glutamine (Lonza Ref. BE12-702F)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
Culture Medium C:
RPMI 1640 Medium with L-Glutamine (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
Culture Medium D:
RPMI 1640 medium with L-Glutamine (bicarbonate buffered) (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
+ Ultroser G (1%) (Pall Ref. 15950-017)
+ HAT (Hypoxathine, Aminopterin, Thymidine) supplement which is usually 50X (dilute 10ml in 500mls of medium) (Gibco Ref. 21060-017)