Calmodulin
これは、無機化学者の視点からカルシウムシグナルタンパク質であるcalmodulinを紹介するビデオです!
カルモジュリン、またはCaMは、すべての真核細胞に遍在しているポリペプチドである。 このタンパク質は、カルシウムシグナル伝達の過程において重要な役割を果たすカルシウム調節タンパク質であるため、カルモジュリンとして知られている。 カルシウムシグナル伝達は、カルシウムイオンと多数のタンパク質との間の相互作用が細胞間の通信を仲介するプロセスである。 したがって、カルモジュリンの機能は、すべての真核細胞において必要であり、それが達成するのに役立つタスクのいくつかは、神経シグナル伝達、骨格筋の動き、および記憶である。 環境中のカルシウムイオンを感知することにより、カルモジュリンは活性化し、その後中間体として作用し、キナーゼなどの重要なタンパク質の結合を開始し、基本的かつ洗練された機能(”カルモジュリン”)で私たちの細胞を支援する。
下のビデオは、カルシウム結合(PDBコード3CLNと1CFD)中にCaM内で起こる構造変化を示しています。
タンパク質自体は長さが148アミノ酸であり、それぞれ2つのEF-handモチーフを含む2つの球状領域であり、カルシウム媒介ポリペプチドの特徴的な部位である。 活性化されると、カルモジュリンはタンパク質の形状を劇的に変化させる4つのCa2+イオンを収容する。 カルモジュリンがカルシウムイオンと結合すると、タンパク質はそのアポ型からハロ型に開き、リンカーまたは中央テザー領域として知られるαヘリックスを露出させる。 その柔軟性のために造語され、中央テザー領域は、パートナータンパク質が結合し、カルシウムの二次メッセージングであるカスケードに寄与するタンパク質の位置である。 その構造と機能するカルシウムイオンの必要性に基づいて、カルモジュリンは細胞質内のカルシウムイオンを選択することができなければならず、EFハンドドメイン内のイオンとリガンドとの間の相互作用は、選択性のこの考えを支持する(Bertini et. アル, 635-638).
この画像は、EF-handモチーフが手にどのように似ているかを描写したものです。 左のリボン図は、カルモジュリンの四つの特徴的なヘリックスターンヘリックスEFハンドモチーフの一つを示しています。 (PDBコード3CLN)
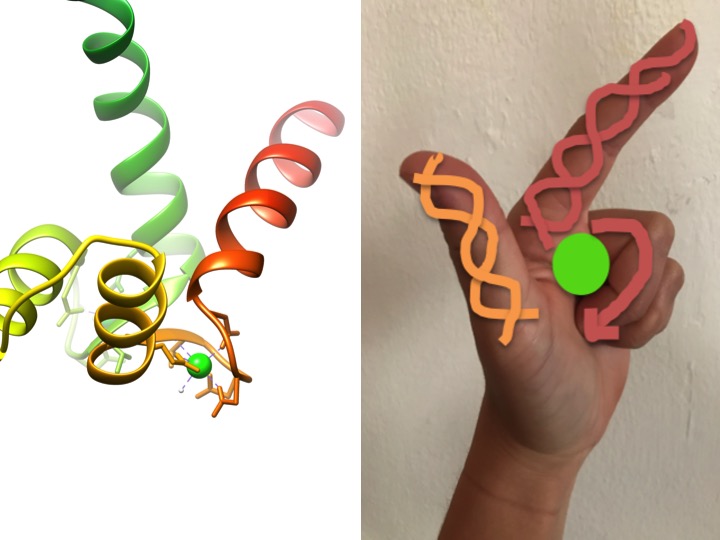
EFハンドモチーフは、カルシウムの結合に関与するタンパク質の高度に保存された構造領域です。 これらの領域は、金属イオンが拳の中央に位置するLの形で作られた手に似ているため、”手”モチーフとして知られており、αヘリックスは上向きの人差し指と内向きの親指で示され、カールした指はターンまたはループ領域を表す。 これは上の図で示されています。 特徴的なEF-handモチーフでは、グルタミン酸塩、アスパラギン酸、アスパラギン酸、およびグルタミン酸を含むアミノ酸は、Caおよび水に結合する(Bertini et. アル 639). 典型的なEF-handドメイン結合シーケンスを下の図に示します。
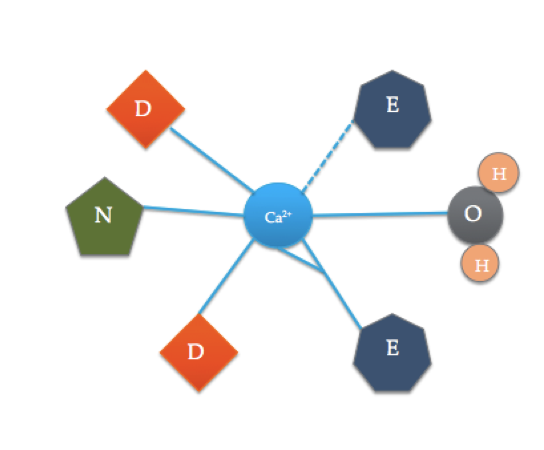
この漫画は、典型的なEFハンドドメインの配位アミノ酸を示しています(正確なアミノ酸組成は異なります!). 実線は側鎖または水への配位を示しながら、破線は、バックボーンカルボニルの酸素へのCaの配位を表します。
カルモジュリン結合部位は、上記の最も典型的なEFハンドドメインとは多少異なります。 カルモジュリンの6つの配位子には、3つのアスパラギン酸(D)の側鎖、1つのグルタミン酸(E)がイオンと2つの配位共有結合を形成し、1つの溶液からの水分子、1つの骨格からのカルボニル分子が含まれる。 カルモジュリンの結合部位は、Ca2+イオンが6つの配位子に囲まれ、7つの結合を形成している。
カルモジュリン内のEFモチーフには、同じ配位子の多くが含まれており、異なる場所にあることに気付くことができます。 この立体配座は、カルモジュリンがカルシウムに対して選択的である理由と、カルシウムイオンの存在のみがタンパク質を活性化させる結合部位をどのように満たすことができるかのアイデアを貸すかもしれない。 これは、細胞内のカルモジュリンの熱力学と、それがカルシウムイオンの存在にどのように応答するかに関連している。
カルモジュリンの活性化を結合させる熱力学を理解するためには、まず真核細胞内のカルシウムやマグネシウムなどのイオンの濃度(ヒトを含む)を理解する必要がある。 これらのイオンの濃度は密接に調節されなければならない。 細胞内では、カルシウムシグナル伝達は、カルモジュリンなどのタンパク質によって感知されるカルシウムイオンの濃度の一時的な増加を伴う(Bertini et. アル, 636). このカルシウムサージは,粗く滑らかな網状体がカルシウムを放出するよう誘導する細胞内G蛋白質によるものであるか,またはカルシウムイオンが細胞外空間から持ち込まれる可能性がある。 カルモジュリンの場合、それは通常、神経シグナル伝達のようなプロセスの間に起こる外部から細胞に持ち込まれるカルシウムに応答している(Bertini et. アル 637). カルシウムの集中が一時的に上がる前に、細胞内の集中は1,000-100,000nmにイオンの短い流入の間に、集中が増加する一方、通常10-100nmの間にあります。 濃度の変化は、カルモジュリンがカルシウムイオンを感知し、それらを結合させ、さらなるシグナル伝達を開始させる(Bertini et. アル, 635).
それでは、カルモジュリンはどのようにしてカルシウムイオンと決定的に結合し、例えばマグネシウムイオンとは結合しないのでしょうか? Mg2+イオンはカルシウムイオンに実際にかなり類似しています: それらは共有結合ではなく静電相互作用に関与し、それらは硬い原子と考えられている。 カルモジュリンがマグネシウムイオンよりもカルシウムイオンを好む理由は,各イオンの結合定数に関係している。 カルモジュリンはマグネシウムなどの他のイオンに結合している間に存在することができるが、カルシウムの濃度が高い場合、カルシウムイオンはすぐにマグネシウムイオンを競合してカルシウム結合部位を占有する。 これは、図7に示すように、CaMとCa2+(Ka)の結合定数がCaMとMg2+の結合定数よりも大きいためです。 これは、カルシウムイオンに結合すると、カルモジュリンがより多くの生成物を生成することを示している。 一つは、このプロセスは、毎秒無数の時間が起こることを念頭に置いて、これらのアイデアのすべてを考慮する必要があり、このタンパク質のターンオーバーは、細胞のこれまでに変調されたカルシウム濃度に応答するように変化します。
なぜカルモジュリンはカルシウムイオンとの結合が他の金属よりも有利なのですか? これは配位子によって誘導される立体障害に関連したイオンの大きさのためである可能性がある。 結合部位は6つの配位子が7つの配位結合を形成することを特徴とする。 図8に示すように、カルシウムイオンはマグネシウムイオンよりも大きいため、配位子同士の距離が長くなり、配位子間の立体的相互作用が減少するため、カルシウムが好まれる可能性があります。 タンパク質自体の構造自体もまた、カルシウムイオンの選択性の理由をもたらす可能性がある。 全体的に、カルシウムイオンの細胞濃度の変化に基づく熱力学のために、カルモジュリンはイオンの増加を感知し、それらを結合し、その機能を遂行
CaM+Ca2+<–>Ca2+CaM(KCaM-Ca)
CaM+Mg2+<–>Mg2+CaM(KCaM-Mg)
Mg2+-CaM+Ca2+<–>Ca2+CAM+Mg2+
Kcam-Ca>Kcam-Mg
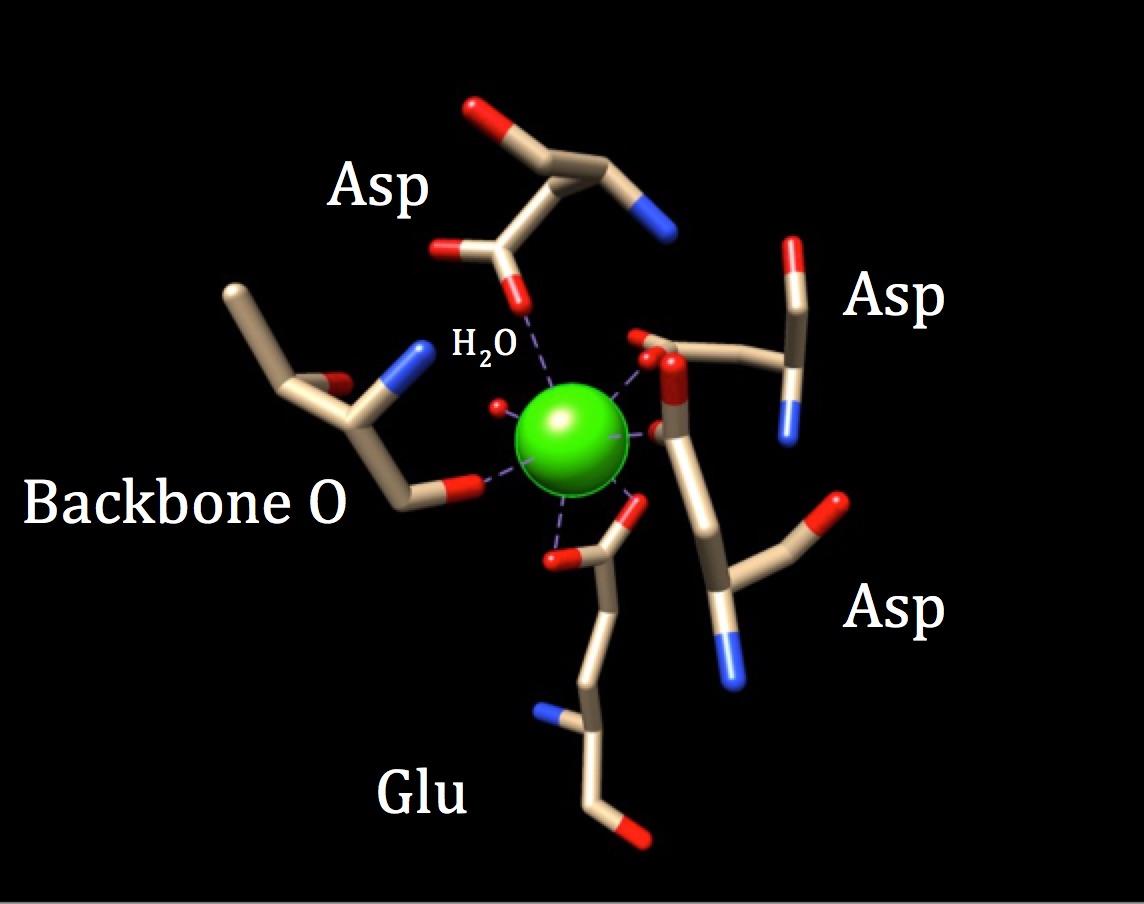
カルモジュリンの結合部位の化学的性質をさらに検討するため、配位幾何学を検討する必要があります。 カルシウムイオンは7つのドナー原子と相互作用するので、この系は七座系として知られている。 カルモジュリンは六つの配位子に囲まれているので、八面体配位幾何学を仮定する。 しかし、配位子の一つがイオンと二座式で相互作用するため、一つのアミノ酸の異なる原子から来る二つの配位共有結合を有することを意味する—配位複合体は歪んだ八面体形状をとる。 具体的な調整は、下の図に概説されています。
カルモジュリンのカルシウム結合部位の配位幾何学。 中心のカルシウム金属イオンは、三つのアスパラギン(Asp)、一つの骨格酸素、一つのグルアトミン酸(Glu)と一つの水分子によって囲まれています。 (PDBコード3CLN)
また、カルモジュリンが高い親和性で金属イオンに結合する能力をよりよく理解するために、キレート効果の理論を参照することもできます。 キレート剤は、複数のドナー原子と結合することができる原子である。 多座結合は、配位子が多くのドナー基(ポリ)と結合すると、配位共有結合がはるかに強く、またはより緊密に保持されることを示すキレート効果に関連する。 この理論は熱力学によって裏付けられており、特に多座結合は系のエントロピーを増加させ、より正(より多くの無秩序)にし、熱力学的に有利である。 この理論をカルモジュリンに適用することは、サイト自体内のポリデンデン酸結合の重要性だけでなく、その機能を活性化するために4つの異なるカルシウムイオンを結合するタンパク質の必要性を説明するのに役立つ。 サイト内の4つのCa2+イオンの結合を本質的に必要とすることによって、システムはより多くの基質/反応物を導入してより多くの生成物を形成す これは、各結合部位のリガンド相互作用内の結合の数が多いために起こる。 全体として、ポリペプチドの場所のカルシウムイオンの結合はキレート効果理論によって支えられ、結合カルシウムのcalmodulinの効率でライトを取除きます。
EF-handモチーフは、カルシウムが中心金属であるという事実に基づいて一定の構造を持っています。 これはカルモジュリン結合部位にも当てはまる。 Ca2+イオンは、硬質/軟質酸塩基理論と呼ばれる理論に基づいて、特定のアミノ酸の構造中の同様の原子と結合する。 この理論は,分極性とその電荷対半径比に基づいて金属と配位子を二つのカテゴリーに分けた。 硬い酸と塩基はサイズ比に大きな電荷を持っている小さなイオンであり、これは静電的な方法で相互作用する(+と–電荷の間の魅力を意味する)のに対し、柔らかい酸と塩基はサイズが大きく、したがって半径比に小さい電荷を持ち、共有結合性を持つ結合を作るように導く。 「Likeはlikeと結合する」というフレーズは、硬質酸および塩基が他の硬質原子と相互作用する傾向があり、軟質酸および塩基についても同様であるという Ca2+は、大きな半径を持っていますが、ほとんど静電的に配位子と相互作用するため、硬質酸として特徴付けられます。 カルモジュリンのカルシウム結合部位を見ると、カルシウムイオンがアスパラギン酸、グルタミン酸、水、カルボニルの3つの酸素原子に結合することがわかる。 この結合は、水とアミノ酸配位子であるグルタミン酸とアスパラギン酸が、硬い塩基として特徴付けられる酸素供与体を介して結合するため、”like binds with like”と一致している。 図10では、カルモジュリンの結合部位を再訪しながら、青色で示されたカルシウムイオンと相互作用するアミノ酸の負の側鎖を示しています。
結合した配位子のドナー原子と配位錯体に電子対を供与する能力について、spectrochemicalシリーズは原子が中心金属とどのように相互作用するかを説明しています。 カルシウム結合部位の場合、Ca2+イオンと相互作用する酸素は、ドナー酸素が2つ以上の電子対を有するため、すべてπドナーおよびπドナーとみなされる。 電子の利用可能性と寄与を指定する分光化学的分類のカテゴリーは、d電子がその軌道をどのように埋めるかを指定するスピン指定(低または高)、および金属のd軌道の間のデルタ(Δ)サイズに影響を与えるが、カルシウムのd軌道は価電子の欠如のために占有されていないため、これはカルシウムに違いを生じさせない。 これにより、タンパク質に関するほとんどの会話でd軌道は本質的に無視できるようになります。 一つの例外は、システム内のカルシウムイオンの不安定性を考慮することに関連している。
Caのd軌道に電子がないと、配位子場安定化エネルギーがゼロになり、カルシウムイオンの高い不安定性が説明されます。 不安定性とは、配位錯体で配位子を置き換えることができる速度を指し、したがって、システムの速度論を記述する。 原子は配位子を迅速に交換すれば不安定である。 すべての真核細胞におけるその適切な機能のために、カルモジュリンは、カルシウムイオンの移動を介して周囲の細胞からのメッセージを送受信するた カルモジュリンがCa2+を迅速に結合して放出する能力については、価電子軌道の占有率を考慮することが重要である。 前述のように、カルシウムは空の原子価d軌道を持っています。 これらの占有されていない軌道は、Ca2+イオンの不安定性の説明を引き起こす可能性がある。 カルシウムイオンのd軌道はすべて空であるため、配位子場安定化エネルギー(LFSE)は0である。 これは、安定な分子が通常LFSEに対して負の値を有するという事実のために、lfseを考慮すると、カルシウムが不安定であることを示している。 この場合の不安定性は、迅速に反応し、複合体のオンとオフを移動する意欲に変換され、Ca2+イオンは速い反応を促進し、不安定であると特徴付けることができるという主張を支持する。 これはキレート効果を含む議論には直感的ではないようですが、これら二つの理論は互いに矛盾しないことが理解されています。 キレート効果によって提案される堅く握られた調整の結束の安定性はカルモジュリンが補足蛋白質を結合するには十分に長く安定している残る それが完了し、カルシウムの集中が常態に戻れば、カルシウムイオンの場所を除去することで有効です。
カルモジュリンは、その構造とその重要な結合部位の組成に基づいて、真核細胞によって行われる無数のプロセスの不可欠な部分を果たしています。 シグナル伝達におけるカルシウムイオンの受容と結合により、カルモジュリンは、ヒトなどの生物における基本的かつ高レベルの機能の重要な成分と 生物有機理論を適用し、真核細胞の微妙に監視された環境の理解を把握することによって、1つは適切にカルシウムイオンを選択し、100以上のパートナー