Ioniske Elektrolytter
Vann Og andre polare molekyler er tiltrukket av ioner, som vist I Figur \(\PageIndex{2}\). Den elektrostatiske tiltrekning mellom et ion og et molekyl med en dipol kalles en ion-dipol tiltrekning. Disse attraksjonene spiller en viktig rolle i oppløsningen av ioniske forbindelser i vann.
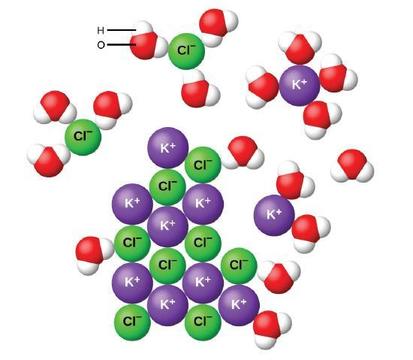
når ioniske forbindelser oppløses i vann, separerer ionene i det faste stoffet og sprer seg jevnt gjennom løsningen fordi vannmolekyler omgir og solverer ionene, og reduserer de sterke elektrostatiske kreftene mellom dem. Denne prosessen representerer en fysisk endring kjent som dissosiasjon. Under de fleste forhold vil ioniske forbindelser dissosiere nesten helt når de oppløses, og de klassifiseres som sterke elektrolytter.
la oss vurdere hva som skjer på mikroskopisk nivå når vi legger fast KCl til vann. Ion-dipolkrefter tiltrekker den positive (hydrogen) enden av de polare vannmolekylene til de negative kloridioner på overflaten av det faste stoffet, og de tiltrekker de negative (oksygen) endene til de positive kaliumioner. Vannmolekylene trenger inn mellom individuelle K+− Og Cl-ioner og omgir dem, reduserer de sterke interioniske kreftene som binder ionene sammen og lar dem bevege seg ut i løsningen som solverte ioner, som Figur viser. Reduksjonen av den elektrostatiske tiltrekningen tillater den uavhengige bevegelsen av hver hydrert ion i en fortynnet løsning, noe som resulterer i en økning i forstyrrelsen i systemet ettersom ionene endres fra deres faste og bestilte posisjoner i krystallet til mobile og mye mer uordnede tilstander i løsningen. Denne økte lidelsen er ansvarlig for oppløsningen av mange ioniske forbindelser, inkludert KCl, som oppløses med absorpsjon av varme.
i andre tilfeller er de elektrostatiske attraksjonene mellom ionene i en krystall så store, eller ion-dipolens tiltrekkende krefter mellom ionene og vannmolekylene er så svake at økningen i uorden ikke kan kompensere for energien som kreves for å skille ionene, og krystallet er uoppløselig. Slik er tilfellet for forbindelser som kalsiumkarbonat (kalkstein), kalsiumfosfat (uorganisk komponent av bein) og jernoksid (rust).