Dimethyl Sulfoxide Oxidations
Dimethyl sulfoxide-based oxidation of primary alcohols to aldehydes or secondary alcohols to ketones is a mild method that does not depend upon heavy metal oxidants. Here is a brief, chronological history of the procedure.
Index:
-
Swern Oxidation (trifluoroacetic anhydride)
-
Swern Oxidation (oxalyl chloride)
Kornblum Oxidation: (1959) et primært tosylat oppvarmes ved 150o for å forårsake SN2-forskyvning av oksygen av dimetylsulfoksid (DMSO) i nærvær Av NaHCO3. Den aksepterte mekanismen på den tiden var en e2 eliminering som vist. Dimetylsulfid (dms) er reduksjonsproduktet av reaksjonen. Dette arbeidet dannet tosylatet fra alkyljodidet med sølvtosylat. Formentlig kan tosylatet fremstilles fra alkoholen som er en mer direkte rute. Ulempen av prosedyren er den forhøyede temperaturen, selv om kontakttiden er bare noen få minutter. Det viktigste problemet er å finne en metode for å generere sulfenatsaltet.

Barton Modification: (1964) Barton og kollegaer var i Stand til å generere sulfenatsalter ved å behandle alkylkloroformater MED DMSO med tap AV CO2. Tilsetning av trietylamin genererer oksidasjonsproduktet. Denne prosedyren forbedret De tøffe forholdene I Kornblum-prosedyren. Videre er kloroformatet lett tilgjengelig ved behandling av alkoholen som skal oksyderes med overskytende fosgen.

Moffatt-Pfitzner Oksidasjon: (1963) denne varianten av en dimetylsulfoksidbasert oksidasjon ble utviklet ved Syntex. Aktivatoren fremstilles ved protonering av dicykloheksylkarbodiimid (1, DCC), som angripes av dimetylsulfoksid. Intermediate 2 protoneres igjen for å lette tilsetningen av alkohol oksygen på svovelatomet. Stabil dicykloheksyl urea 4 dannes sammen med sulfenatsalt 3. Denne arten lider sammenbrudd til karbonylforbindelsen under påvirkning av dihydrogenfosfatanionen. Selv om fosforsyre er en effektiv syrekatalysator for denne reaksjonen, er svovelsyre, hydrogenklorid og trifluoreddiksyre ikke. Pyridiniumtrifluoroacetat er imidlertid en effektiv katalysator. Det er kritisk at konjugatbasen av syren er grunnleggende nok til å påvirke det siste trinnet i reaksjonen.

Torrsell Mekanisme: (1966) den svenske kjemikeren Torrsell demonstrerte at mekanismen for DISSE DMSO-baserte oksidasjonene ikke fortsetter via en intermolekylær β-eliminering. Eliminasjonen er en intramolekylær prosess. Sulfenatsalt 5 ble fremstilt ved moffatt-Pfitzner-prosedyren (se ovenfor). Hvis Kornblum-mekanismen skulle gjelde, ville det oppnådde dimetylsulfidet være uten deuterium (Eksperiment 1). Imidlertid ble dimetylsulfid-d1 (7) oppnådd. Dette resultatet er i samsvar med en base som deprotonerer metylgruppen festet til svoveldannende ylid 6. Yliden dekomponerer ved intramolekylær deprotonasjon for å produsere de observerte produktene.
Eksperiment 1:

for å bekrefte denne mekanismen ble deuterium inkorporert I DMSO som DMSO-d6. Følgelig produserte reaksjonen dimetylsulfid-d5 (12) og undeuterert aldehyd 11 (Eksperiment 2).
Eksperiment 2:

Parikh-Doering Oksidasjon: (1967) denne oksidasjonen benytter pyridin svoveltrioksydkomplekset (13) som aktivator av dimetylsulfoksid. Sulfat er forlate gruppen i forskyvning av alkohol (primær eller sekundær) i mellom 14. Sulfenat 15 dekomponeres av den intramolekylære mekanismen (vide supra) for å gi et aldehyd eller keton.

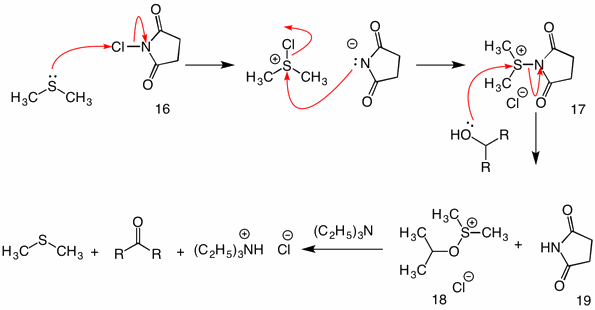
Corey-Kim Oksidasjon: (1972) i denne prosedyren aktiveres dimetylsulfid (oksidert) Med n-klorosuccinimid (16) for å gi reagens 17. I reaksjonen av denne arten med en alkohol fungerer succinimidylgruppen som en forlatelsesgruppe. Det vanlige sulfenat-mellomproduktet 18 kollapser av den intramolekylære mekanismen ved tilsetning av trietylamin.
Swern Oksidasjon: (1976) denne tidlige Swern oksidasjon sysselsetter trifluoreddikanhydrid (20) at-50oC for å aktivere dimetylsulfoksid. Tilsetning av alkohol til mellomliggende 21 gir ønsket sulfenat 22. Ketonet eller aldehydet produseres på vanlig måte med trietylamin.

Swern Oksidasjon: (1978) denne Senere Swern-prosedyren er en praktisk metode for fremstilling av reagens 24 uten bruk av dimetylsulfid og klor. Dimetylsulfoksid, som er på samme oksidasjonsnivå som salt 24, reagerer med oksalylklorid (23) for å frigjøre karbonmonoksid, karbondioksid og reagens 24. Tilsetning av primær eller sekundær alkohol etterfulgt av deprotonering av sulfenat 25 med trietylamin fører til henholdsvis ønsket aldehyd eller keton.
