- Protokoller
- Hybridomproduksjon
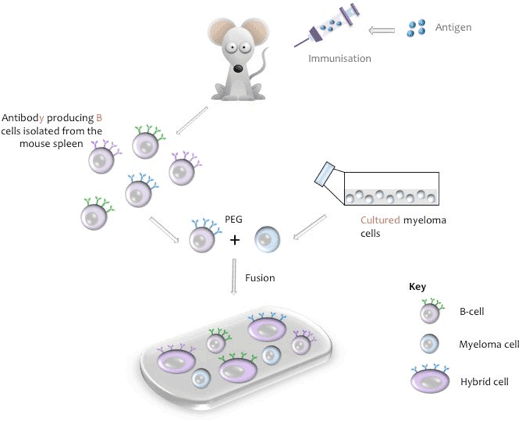
- Skjematisk fremstilling av cellefusjon
- Utstyr som trengs
- Medium og andre reagenser (Se Vedlegg A for mer informasjon)
- Før du begynner (se Vedlegg A for mer informasjon)
- Tining og vekst av myelomcellene
- fusjonsprosessen
- Tre dager Før-Forbered myelomcellene for fusjonen
- en dag før – forbered mediet
- fusjonsdag
- Dag etter fusjonen
- Tillegg i
Protokoller
Hybridomproduksjon
et hybridom er en cellelinje som oppstår fra en hybridcelle som er i stand til å utskille et monoklonalt antistoff spesifikt for en epitop av antigenet permanent i kultur. Hybridcellen er produsert gjennom fusjon av spesifikke antistoff som produserer B-celle Fra et immunisert dyr (vanligvis en mus, rotte eller kanin) og som har en begrenset levetid, med en celle fra en» utødelig » dyrket myelomcellelinje (f.eks. mus NS-1 eller NS-0).
Produksjon av en mus hybridcelle
Under fusjonsprosessen isoleres B-celler fra musemilten, blandes med musens myelomcellelinje og fusjon induseres med polyetylenglykol (PEG, Se Vedlegg I). (Den relevante myelomlinjen brukes når B-celler fra andre dyrearter brukes). De resulterende hybridomene blir deretter dyrket i vevskulturmedium som inneholder Hypoksatin, Aminopterin, Tymidin (HAT), et trinn som dreper eventuelle ubrukt myelomceller som kan vokse ut av de andre svakere hybridomcellene. Unfused b-celler har begrensede krefter divisjon og vil dø av naturlig i kultur. Ti dager etter fusjonsprosessen samles kultur supernatant og testes for tilstedeværelsen av det ønskede antistoffet.
Skjematisk fremstilling av cellefusjon
Utstyr som trengs
- et sterilt miljø for å forberede og håndtere celler (laminær strømning eller klasse II skap)
- en inkubator satt TIL 37º, med 5% CO2 og fuktighet på 95%
- et invertert mikroskop
- ET 37º vannbad som kan plasseres i skapet
- en sentrifuge med en swing-out rotor
- sterile dissekere instrumenter-ideelt to sett – hver bestående av to par saks og TANG (en buet og en butt endte).
- 75 ml vev Corning kultur kolber-Ref. 15430641
- 24 brønnfalkplater-Ref. 353047
- Sterile pipetter
- Pipettfyller
- Sterile pasteurpipetter
- a-timer
Medium og andre reagenser (Se Vedlegg A for mer informasjon)
- rpmi 1640 bikarbonatbufret, med L-Glutamin (Lonza Ref. BE12-702F)
- RPMI 1640 Hepes bufret,uten L-Glutamin
- God kvalitet (batch testet) Føtal Bovint Serum (Genycell Ref. GCS0101-500)
- Penicillin / Streptomycin (Gibco Ref. 15070-063)
- Ultroser G (Pall Ref. 15950-017)
- HATT (Hypoksatin, Aminopterin, Tymidin) (Gibco Ref. 21060-017)
- PEG 1500 (Roche Ref. 10783641001)
Før du begynner (se Vedlegg A for mer informasjon)
- Lag 500 ml Av A
- Lag 500 ml medium a+
- Lag 100 ml medium b
- Lag 100 ml medium c
- Lag 500 ml medium d
Tining og vekst av myelomcellene
Tine myelomcellelinjen Og Vokse I Medium A. Bruk følgende metode for å tine og kultur myelom cellelinjen.
- Fjern det frosne hetteglasset med myelomceller fra LN2-lageret.
- Plasser cellene i et 37º vannbad.
- Hold lokket på hetteglasset med frysing over vannoverflaten for å redusere risikoen for kontaminering.
- når cellene er nesten tint (bare en liten del av isen gjenstår) flytte til vev kultur panseret.
- Tørk av utsiden av hetteglasset med 70% etanol og fjern toppen.
- fjern cellesuspensjonen Forsiktig Med en steril Pasteur-pipette.
- Overfør innholdet til et sentrifugerør som inneholder 10 ml medium A (se vedlegg A)
- Spinn cellesuspensjonen forsiktig ved 300 g i 5 min.
- Fjern supernatanten og resuspend cellene i 10 ml ferskt medium A og plasser i en liten (25cm2) kolbe.
- Ta 1 ml av suspensjonen fra den opprinnelige kolben og legg til en annen med 9 ml medium a. dette sikrer at hvis konsentrasjonen i den første kolben er for høy, er en andre (lavere) konsentrasjon av celler tilgjengelig.
- Sett flaskene i CO2-inkubatoren. Husk å la flaskelokkene være litt åpne for å tillate gassformig utveksling.
fusjonsprosessen
Tre dager Før-Forbered myelomcellene for fusjonen
myelomcellene må være i eksponentiell vekstfase når du bruker dem, og dette trenger erfaring. Men hvis du setter opp to 75 cm2 kolber av myelomcellene dine, en ved en fortynning på 1:40 og en ved 1:60 (se nedenfor), 3 dager før fusjonen, bør en av kolber være ideell på fusjonsdagen. (Først sette opp flere kolber ved fortynninger over og under de som er gitt her, bør gi deg den nødvendige opplevelsen dømme vekstraten til myelomcellene for påfølgende fusjoner).
en dag før – forbered mediet
følgende må gjøres og forvarmes TIL 37º (du kan sette dem i inkubatoren din over natten).
- To x 200 ml medium a+ i to 75cm2 kolber
- 100 ml medium b
- 100 ml medium C
- 1×4 ml PINNE 1500 overført til en folie innpakket (PINNE er lysfølsom) steril universell
- en mini 100 ml Destillert vann og krysset med tape bred nok slik at det er en åpning for å holde et 50 ml falkrør oppreist
fusjonsdag
- drep musen (etter institusjonelle retningslinjer), trekk UT MILTEN og sett DEN I en steril beholder som inneholder 5 ml av medium C.
- alle etterfølgende trinn må utføres i en laminær strømningshette.
- Sett milten og mediet i en petriskål.
- Flytt milten med sterile tang for å vaske den. Fjern eventuelle adhesjoner og overfør milten til en annen petriskål
- Skjær milten i to. Hold en halv med sløv tang og bruke et annet par buede tang, forsiktig erte cellene ut fra milten kapsel, være forsiktig med å fjerne så mange celler som mulig. Gjenta med andre halvdel av milten
- Fjern miltkapselrester og bruk en steril Pasteur-pipette til å blande cellene godt, men veldig forsiktig.
- Overfør cellesuspensjonen til et 15 ml rør og bruk en annen 5 ml medium C for å skylle petriskålen og legge til miltcellene i røret.
- Telle myelom og miltceller.
- du trenger et forhold på 1 myelomcelle til hver 10 miltceller
- Legg myelomcellene til et 50 ml konisk rør.
- Sentrifuger både miltcellene (15 ml rør) og myelomcellene i (50 ml rør) for 300g i 10 minutter.
- Hell Forsiktig av supernatanten av begge rørene og forsiktig resuspend pellets hver i 10mls medium B. fraværet AV FBS til fusjonsprosessen er fullført er ekstremt viktig da celler ikke vil smelte hvis DET er FBS tilstede)
- Kombiner den resuspenderte miltcellen og myelompellets i ett 50 ml sentrifugerør.
- Sentrifuge i 5 minutter ved 300g.
- Hell forsiktig av så mye supernatant som mulig.
- Resuspend pellet ved å trykke røret forsiktig på benken. Ikke flick pellet eller pipette det som dette vil distribuere celler opp rundt røret redusere celle tall som er tilgjengelige for fusing.
- Plasser røret i det hjemmelagde vannbadet.
- Tilsett 1,2 ml PEG dråpe for dråpe over ett minutt, rør forsiktig med noen få dråper.
- Tilsett 1 ml medium B, dråpe for dråpe over ett minutt, rør forsiktig med noen få dråper.
- Legg til ytterligere 2 ml medium B, slipp for dråpe over to minutter, rør forsiktig med noen få dråper.
- Tilsett ytterligere 4 ml medium B, dråpe for dråpe over fire minutter, rør forsiktig med noen få dråper.
- på slutten av tiden, legg til 8 ml medium C.
- Sentrifuge røret av celler i 5 minutter 300g.
- dekanter supernatanten veldig nøye og resuspend cellepellet i 1 minutt med 10 ml medium a+. For å gjøre dette, legg til noen ml av mediet for å begynne å bryte opp pelleten. Sug opp disse klumpene av celler veldig forsiktig og beveg deg opp og ned i pipetten. Utvis disse cellene og gjenta prosessen. Vær veldig forsiktig, ikke tving pellet fra hverandre, du kan ha små klumper av celler når du er ferdig. Cellene er ekstremt skjøre på dette stadiet.
- Sett 10 ml resuspendert fusjonsmiks i 190 ml varmt medium A +
- det endelige volumet er 200 ml
- Sett 1 ml av denne suspensjonen i hver brønn med 8 x 24 brønnplater (2 ml). (192 brønner totalt)
- La platene stå i inkubatoren over natten (omtrent 24 timer).
Dag etter fusjonen
- Legg til 8 ml LUE i 200 ml medium a+.
- Sett 1 ml av dette selektive mediet i hver brønn på de 8 platene.
- La platene stå i inkubatoren. Koloniene vil vises mellom 7 til 10 dager

Tillegg i
Kulturmedium A:
rpmi 1640 medium med L-Glutamin (bikarbonatbufret) (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100u / ml) / Streptomycin (100 mg/l) (Gibco Ref. 15070-063)
Kulturmedium A+:
RPMI 1640 medium with L-Glutamine (bicarbonate buffered) (Lonza Ref. BE12-702F)
+10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
+ Ultroser G (1%) (Pall Ref. 15950-017)
Culture Medium B (no FBS):
RPMI 1640 Medium with L-Glutamine (Lonza Ref. BE12-702F)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
Culture Medium C:
RPMI 1640 Medium with L-Glutamine (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
Culture Medium D:
RPMI 1640 medium with L-Glutamine (bicarbonate buffered) (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
+ Ultroser G (1%) (Pall Ref. 15950-017)
+ HAT (Hypoxathine, Aminopterin, Thymidine) supplement which is usually 50X (dilute 10ml in 500mls of medium) (Gibco Ref. 21060-017)