- Plastisitet Av VSMCs I Fysiologi og Sykdom
- VSMCs Påvirker Adventitia Immunresponser I Hyperlipidemiske Mus
- Aldring Eller Kronisk Eller Begge deler?
- Nydannede Adventitiastrukturer Deltar i atlo-Funksjonen Ved Å Fremme Lymfocyttresirkulasjon
- Atlo-Formasjonen Er Sterkt Territorialisert, Noe Som Indikerer At Signaler Overføres Fra Plakk til Adventitia via Lymfoid Vevsarrangørlignende VSMCs
- VSMCs Bidrar Direkte Til Adventitia Immunitet I Aterosklerose
- Konklusjon
- Forfatterbidrag
- Finansiering
- Interessekonflikt Erklæring
Plastisitet Av VSMCs I Fysiologi og Sykdom
Vaskulære glatte muskelceller (VSMCs) er de viktigste bestanddelene i mellomstore og store arterier. Selv om mekanismer for atherogenese i stor grad forblir definert, har studier vist at sykdomsprogresjon innebærer krysstalk mellom immunceller med Både ECs og VSMCs. Noen av disse interaksjonene fremmer plakkvekst mens andre demper størrelsen, cellulær sammensetning og stabilitet av aterosklerotiske plakk (1, 2) (Figur 1, Tabell 1). VSMCs viser bemerkelsesverdig plastisitet som respons på vaskulær skade, betennelse og lipoproteinakkumulering under sykdomsprogresjon via omprogrammering av genuttrykk og et skifte til en proliferativ, pro-migrerende og aktivert fenotype, dvs. fenotypesvitsjing (5). I Figur 1 skildrer vi kritiske molekylære brytere som har blitt foreslått å være viktige regulatorer av sykdomsprogresjon (3, 6, 8, 11). Under aterosklerose initiering, blod-avledede monocytter, som har blitt rekruttert inn i intima, akkumulere lipid gi dem en skummende utseende. Disse skumcellene bidrar til fettstrekdannelse som utgjør det tidligste og muligens reversible stadiet av aterosklerotiske plakk. Fettstreker utvikler seg gradvis til atheromer / plakker som til slutt fører til utvidede plakker som inneholder VSMCs, T-celler og myeloide celler (Figur 1) (33). Intriguingly, sammensetningen av en aterosklerotisk plakk i stedet for dens størrelse bestemmer dens stabilitet som fibrøs cap tykkelse og nekrotisk kjernestørrelse er potensielle kjennetegn ved en stabil vs. en ustabil plakk, henholdsvis (4, 9). Vsmc i intima-laget er tradisjonelt sett på som gunstig under atherogenese fordi de produserer ekstracellulære matrikskomponenter, og derved fremmer dannelsen av sterkere fibrøse caps som resulterer i beskyttelse mot plakkbrudd (4, 9). Det er stadig tydeligere At Vsmc gjennomgår en mengde strukturelle og funksjonelle fenotypiske transformasjoner og kan til og med helt miste sine opprinnelige egenskaper for å skaffe seg egenskaper hos andre celletyper, inkludert makrofager. Data indikerer At VSMCs kan erverve dikotomiske fenotyper Med Janus-hodetype, dvs. pro-vs. antiaterogene egenskaper, avhengig av vevsmiljøet og virkningen av risikofaktorer (3). VSMCs frigjør cytokiner for å stimulere Tilstøtende ECs til å uttrykke adhesjonsmolekyler og frigjøre cytokiner, og / eller forbedre kjemotaksen av monocytter / makrofager i plakket (3, 34, 35) (Tabell 1). Disse dataene indikerer at akkumulering Av VSMCs i fibrøs cap eller intima er gunstig, mens deres tap eller overgang til en inflammatorisk fenotype er skadelig, og at balansen Mellom VSMCs proliferasjon / migrasjon vs død / senescens bestemmer atheroprogression vs plakkstabilitet (3). Ulike tilleggsaspekter AV vsmc biologi i helse og sykdom ble nylig dekket av en rekke gode anmeldelser (https://academic.oup.com/cardiovascres/issue/114/4) og vil ikke bli dekket her. Nedenfor fokuserer vi derfor på adventitias rolle og Den potensielle virkningen Av VSMCs i ATLO-formasjonen.

Figur 1. Fenotyper Av VSMCs under aterosklerose progresjon avslører ekstraordinær plastisitet. ECs og VSMCs i aterosklerotiske plakk viser aktiverte fenotyper ( ② ) (3, 4). Noen Av Vsmc stammer fra media etter rekruttering til intima; andre Vsmc – er kan være benmargsavledede eller de kan stamme fra myeloide celler i sirkulasjonen ( ④ ) (3). En brøkdel Av Vsmc-er sprer seg ( ② ) (3, 5). Vsmc skiller ut ekstracellulære matrikskomponenter; den pluripotente transkripsjonsfaktoren, Dvs. Klf4, kan spille en viktig rolle i en prosess som kalles fenotypesvitsjing (henholdsvis 6, 7). I forsøk på å skjerme aterosklerotisk plakk fra dødelig ruptur, Kan Oct4 styre en prosess som har blitt kalt remigrasjon for å danne en fibrøs hette ( ① ) (4, 8-10). Senescens og apoptose utløser genereringen av ytterligere inflammatoriske cytokiner for å danne en nekrotisk kjerne som starter en ond syklus med dødelige kliniske konsekvenser i de sene stadiene av sykdommen (recjust) (3, 4, 11).
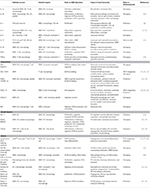
Tabell 1. Viktige inflammatoriske mediatorer involvert I vsmc-mediert aterosklerose immunitet.
VSMCs Påvirker Adventitia Immunresponser I Hyperlipidemiske Mus
i løpet Av de siste to tiårene ble det stadig tydeligere at adventitia er et svært komplekst og immunologisk aktivt vev som har celler så forskjellige som stromale celler, nerver, lymfekar, vasa vasora og bosatt leukocytter/stamceller som alle har evne til å påvirke sykdomsprogresjonen (36, 37). Vi observerte at adventitia Av ApoE – / – mus gjennomgår store restruktureringshendelser i alle stadier av aterosklerose: Både medfødte og adaptive immunceller akkumuleres ved siden av de nærliggende aterosklerotiske plakkene(Figur 2). Videre ble våre studier i eksperimentelle mus bekreftet i humane syke arterier: Vi og andre observerte ATLO-lignende strukturer i adventitia hos pasienter som presenterer aterosklerotiske aortaaneurysmer (38, 39) og nylig, Akhavanpoor et al. observert velutviklet ATLOs i adventitia av en betydelig andel av pasienter rammet av iskemisk hjertesykdom (40). I murine aterosklerose, lymfe fartøy-, høy endotel venule (HEV) -, og blod fartøy neogenesis er fremtredende trekk ved denne omstillingsprosessen (16, 41).
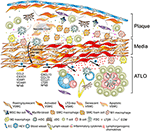
Figur 2. Vaskulære glatte muskelceller (VSMC) deltar i adventitia-immunitet under plakkdannelse. VSMCs klemt mellom aterosklerotisk plakk og adventitia vedta en lymfoid vev arrangør-lignende fenotype etter aktivering via plakk-avledet signaler ( ② ) og deretter transdifferensiere Til LTo-lignende celler ( ④ ). Ved hjelp av deres proliferative og cytokinuttrykkende fenotype påvirker de restruktureringen og skulpturen av adventitia, inkludert angiogenese, HEV-dannelse og lymfebein neogenese (trombotisk). Fenotypesvitsjing resulterer også i ekspresjon og sekresjon av lymfeorganogene kjemokiner, DVS. CXCL13 og CCL21, og fremmer DERMED ATLO-dannelse avbildet skjematisk i nedre del av grafen (cyrus).
Aldring Eller Kronisk Eller Begge deler?
viktigere, aldring ble funnet å være en viktig determinant av adventitia restrukturering og skulptur. Fullt utviklet ATLOs form under avanserte stadier av aterosklerose, men deres tidlige stadier, dvs. T/b-celleaggregater, dukker opp parallelt med dannelsen av aterosklerotiske plakk (16, 27, 41, 42). Faktisk danner disse tidlige Atloene i en alder av ~30 uker og når mer avanserte stadier på rundt 52 uker til topp på 78 uker (16, 41). Lignende aldersavhengige utviklingsstadier Av TLOs er observert ved andre kroniske uløselige sykdommer (1, 42). DISSE dataene indikerer AT ATLO utvikling er aldersavhengig og aldring er positivt forbundet med adventitial sculpting (Figur 2). Imidlertid er forholdet mellom aldring og kronisitet vanskelig å studere i murine aterosklerose som aterosklerotisk plakk utvikling begynner i aortabuen, deretter reiser sådd aorta å nå abdominal aorta på senere sykdom stadier dermed tar lengre tidsperioder. Mer arbeid er nødvendig for å avklare det viktige spørsmålet om immuncelle og / eller VSMC senescence bidrar TIL ATLO dannelse og hvilke celletyper, dvs., Vsmcs, ECs og / eller immunceller er involvert. Studier i andre former FOR tlo-dannelse som de som forekommer i lungene og mage-tarmkanalen, tyder på at det er kronisiteten til en vedvarende inflammatorisk vevsreaksjon snarere enn bona fide aldringshendelser i immunsystemet som er avgjørende for dannelsen Av ATLOs (43, 44).
Nydannede Adventitiastrukturer Deltar i atlo-Funksjonen Ved Å Fremme Lymfocyttresirkulasjon
Avanserte ATLO-stadier inkluderer T/b-celleaggregater, germinalsentre innenfor aktiverte b-cellefollikler, lymfekar, HEVs i t-celleområder Og ekstracellulære rørmeshworks (16). Disse store endringene ligner strukturer som minner om de som finnes i sekundære lymfoide organer hvor de fremmer grunnleggende aspekter av immunresponser mot antigen, inkludert resirkulering av naï lymfocytter for å finne deres kognitive antigener / autoantigener, og organisere affinitetsmodning Av B-celler mot potensielle autoantigener. Ved hjelp av adoptiv lymfocyttoverføringsstudier observerte Vi At ATLOs i stor grad øker lymfocyttrekrutteringen i arterieveggen ved både å fremme innvandring og samtidig demping av emigrasjon av antigen-uerfarne lymfocytter (27). Etter rekruttering blir T-celler aktivert, begynner å proliferere, og NOEN AV CD4 T-hjelpercellene omdannes til induserte t-regulatoriske celler. Disse dataene viser at immunsystemet i adventitia er svært responsivt mot den underliggende inflammatoriske vevsreaksjonen av arterieveggen. Videre ser B-celler som danner germinale sentre i aktiverte b-cellefollikler ut til å gjennomgå en germinal senterreaksjon i nærvær av follikulære dendritiske celler hvor noen omdannes til minne B-celler mens andre forlater germinale sentre for å bli plasmaceller (45). Når de tas sammen, indikerer disse dataene at ATLOs i stedet for sekundære lymfoide organer (som tidligere antatt) organiserer aterosklerose immunitet.
Atlo-Formasjonen Er Sterkt Territorialisert, Noe Som Indikerer At Signaler Overføres Fra Plakk til Adventitia via Lymfoid Vevsarrangørlignende VSMCs
Et annet aspekt Ved adventitia-restrukturering under atherogenese er AT ATLO-formasjonen er svært territorialisert og i stor grad begrenset til adventitiasegmenter ved siden av aterosklerotiske plakk i abdominal aorta hos mus (16, 45). ATLOs er bare sporadisk funnet i adventitia av innominate arterien eller av aortabuen der aterosklerose er mest fremtredende. Immunceller i thorax-segmentene i aorta består hovedsakelig av t-celleaggregater sammenlignet Med ATLOs i abdominal aorta (16, 41). Den nøyaktige mekanismen for territorialitet Av Atlosdannelse i abdominal aorta er fortsatt ukjent. TLOs ser ut til å være et trekk ved mange kroniske uoppløselige inflammatoriske sykdommer og er fremtredende kjennetegn ved autoimmune sykdommer (42). Cellulariteten og strukturen Til TLOs i aterosklerose ligner TLOs i mange andre kroniske sykdommer, inkludert kreftassosiert tlo-dannelse (46, 47). FELTET TLO biologi har dramatisk utvidet de siste årene heve den viktige muligheten for at nye terapeutiske målet kan identifiseres via forståelse AV TLO funksjon i HVER AV TLO-assosierte sykdommer. Imidlertid avslører De ulike Typer TLOs noen sykdomsspesifikke egenskaper, som til slutt kan avgjøre om de tilknyttede immunresponsene er skadelige eller beskyttende. Slike sykdomsspesifikke egenskaper kan oppstå gjennom en av flere mekanismer, inkludert organspesifisitet og arten av vevsskade (1, 42). Utviklingen av lymfoide organer er en kompleks prosess som involverer hematopoietiske lymfoide vevsinduktorceller (LTi), ikke-hematopoietiske stromale lymfoide vevsorganisatorceller (LTo) og Ltß signalering. Våre in vitro-studier av mus aorta VSMCs indikerte at de ved passende stimulering kan tjene Som LTo-lignende celler (20), opprinnelig identifisert under embryonisk utvikling under dannelsen av sekundære lymfoide vev inkludert lymfeknuter og milt (48, 49) (se nedenfor). Det er viktig å merke Seg At ATLOs ser ut til å involvere VSMCs som viktige deltakere, mens andre TLOs involverer Andre LTo-lignende mesenkymale celler (50). Fellesnevneren for Alle Former For TLOs synes imidlertid å være-i motsetning til sekundære lymfoide organer – en kronisk inflammatorisk vevsreaksjon som driver immunsystemet til å danne disse lymfoide strukturer nær eller i noen tilfeller i det syke vevet (42, 43).
VSMCs Bidrar Direkte Til Adventitia Immunitet I Aterosklerose
i lys Av den høyt territorialiserte naturen Til ATLOs ved siden av aterosklerotiske plakk, begrunnet vi At VSMCs kan være involvert i ATLO dannelse og på samme måte kan vedta en funksjonell rolle i aterosklerose progresjon. Vsmc uttrykker Ltß konstitusjonelt (16), mens dets ligand Lta1ß 2 uttrykkes på forskjellige immunceller kalt LTi-celler (51). VSMCs antas å bli aktivert Gjennom Ltß-LT-signalveien av LTi-celler involvert i sekundær lymfoid vev neogenese. Opprinnelsen Til lti-celle er ennå ikke klart bestemt, selv om aktiverte makrofager og andre immunceller i intima-plakket er kandidater for denne aktiviteten i LTO-neogenese. Som respons på cellulære og oppløselige mediatorer ser Vsmc ut til å gjennomgå en distinkt type fenotype som bytter til En LTo-lignende fenotype ved parakrinsekresjon av lymforganogene kjemokiner, dvs. CXCL13 og CCL21, og tiltrekker dermed immunceller, f. eks. makrofager/dendrittiske celler, T-celler Og B-celler til det lokale adventitiamiljøet som fører til DANNELSE AV ATLO i adventitia (27, 41, 45) (Tabell 1). Global eller VSMC-spesifikk mangel På Ltß hos eldre hyperlipidemiske ApoE – / – mus viste økt aterosklerotisk plakkdannelse, noe som indikerer AT VSMC Lt@r har evnen til å dempe utvikling av aterosklerose under noen eksperimentelle forhold (27). Andre studier viste imidlertid at unge globale ApoE – / – LTbR – / – mus opprettholdt under et høyt fett diett (HFD) viste en lavere aortisk plakkbelastning enn deres normale Diettmatede ApoE – / – kolleger (52). Disse tilsynelatende motstridende dataene indikerer at rollene Til Ltß hos unge mus og under forhold med overdreven hyperlipidemi kan være forskjellige i de to modellene. Alternativt kan høyt fett diett som fører til dramatiske og muligens berusende nivåer av plasma lipider, være ansvarlig for disse forskjellene. Siden Vi ikke regelmessig bruker et høyt fett diett i ApoE – / – mus, forblir disse avvikene uløste problemer, selv om det har vist seg at immunsystemet kan bli overveldet av ekstreme nivåer av plasmalipider . Disse dataene krever videre studier for å undersøke det molekylære grunnlaget for Den tilsynelatende dikotomi Av Ltß i aterosklerose progresjon hos unge vs. alderen mus og / eller tidlig vs. avansert aterosklerose. I tillegg kan benmarg-avledede makrofager fungere Som Ltß-uavhengige lti-celler og utløse ekspresjonen AV CCL19, CCL20 og CXCL16 ved VSMCs (53) (Tabell 1). Dermed Kan VSMCs delta i dannelsen Av TLOs i aterosklerose ved oppregulering av lymforganogene kjemokiner for å fremme immuncelleaggregater i adventitia. Som nevnt ovenfor Er ATLOs vanlige hos mennesker belastet av iskemisk hjertesykdom (40) og i humane aterosklerotiske aortaaneurysmer (38, 39). Når det tas sammen, forekomsten Av ATLOs i eksperimentelle mus og i human aterosklerose reiser viktige spørsmål om arten av aterosklerose som en autoimmun sykdom: det er tenkelig at under atherogenese genereres autoimmune T-celler og autoimmune B-celler rettet mot ennå ikke identifisert autoantigener. Isolering av slike autoimmune lymfocytter inkludert sekvensering av Deres t-cellereseptorer og / Eller B – cellereseptorer ville tillate å teste store hypoteser i aterosklerose. Faktisk vil atheroskleroseforskning gjennomgå et stort skifte, og testing av individuelle autoimmune lymfocyttkloner i funksjonelle in vitro-og in vivo-systemer vil bli mulig.
Konklusjon
Aterosklerose Er en inflammatorisk sykdom i arteriene. VSMCs kommuniserer med Både ECs og immunceller i aterosklerotiske plakk og bosatt celler i adventitia. Denne evnen tillater VSMCs å påvirke aterosklerose immunitet på store måter, inkludert dannelsen Av ATLOs. Videre arbeid er nødvendig for å avgrense VSMCs rolle i ulike stadier Av aterosklerose, bestemme deres rolle i unge vs aldrende arterier, og belyse videre deres dikotomiske roller i sykdomsprogresjon. En bedre forståelse av disse prosessene kan åpne veien for å utvikle terapeutiske strategier for fremtidig intervensjon i klinisk viktige sen-stadier av sykdommen.
Forfatterbidrag
alle forfattere bidro til utforming, skriving og redigering av det innsendte manuskriptet, og godkjente det for publisering.
Finansiering
Interessekonflikt Erklæring
forfatterne erklærer at forskningen ble utført i fravær av kommersielle eller økonomiske forhold som kan tolkes som en potensiell interessekonflikt.
4. Clarke MC, Figg N, Maguire JJ, Davenport AP, Goddard M, Littlewood TD et al. Apoptose av vaskulære glatte muskelceller induserer egenskaper av plaque sårbarhet i aterosklerose. Nat Med. (2006) 12:1075–80. doi: 10.1038 / nm1459
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
5. Owens GK, Kumar MS, Wamhoff BR. Molekylær regulering av vaskulær glatt muskelcelledifferensiering i utvikling og sykdom. Physiol Rev. (2004) 84: 767-801. doi: 10.1152 / physrev.00041.2003
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
6. Shankman LS, Gomez D, Cherepanova Oa, Laks M, Alencar GF, Haskins RM, et al. KLF4-avhengig fenotypisk modulering av glatte muskelceller har en nøkkelrolle i aterosklerotisk plakkpatogenese. Nat Med. (2015) 21:628–37. doi: 10.1038 / nm.3866
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
7. Gomez D, Owens GK. Glatt muskelcelle fenotypisk bytte i aterosklerose. Cardiovasc Res. (2012) 95: 156-64. doi: 10.1093/cvr | cvs115
PubMed Abstrakt | CrossRef Fulltekst / Google Scholar
8. Oa, Gomez D, Shankman LS, Swiatlowska P, Williams J, Sarmento AV, et al. Aktivering av pluripotensfaktoren OCT4 i glatte muskelceller er ateroprotektiv. Nat Med. (2016) 22:657–65. doi: 10.1038 / nm.4109
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
10. J. j. j., j. J. J., J. J. J., J. J. J., J. J. j., J. J. j., J. J. j., J. J. j., J. J. j., J. j. j., Et al. Stabilisering av aterosklerotiske plakk. European Society Of Cardiology (ESC) Arbeidergruppe for aterosklerose og vaskulær biologi. Thromb Haemost. (2011) 106:1–19. doi: 10.1160 / TH10-12-0784
PubMed Abstrakt / Fulltekst / Google Scholar
11. Moj, Moulis M, Roth L, Martinet W, Vindis C, Bennett MR, et al. Vaskulær glatt muskelcelledød, autofagi og senescens i aterosklerose. Cardiovasc Res. (2018) 114: 622-34. doi: 10.1093/cvr | cvy007
PubMed Abstrakt | CrossRef Fulltekst / Google Scholar
14. A. m., A. M., A. M., A. M., A. M., A. M., a. M., a. M., a. M., a. M., a. M., a. M., a. M., et al. De To Ansiktene Til Interleukin-17a I Aterosklerose. Curr Narkotika Mål. (2017) 18:863–73. doi: 10.2174/1389450117666161229142155
PubMed Abstrakt / Fulltekst / Google Scholar
15. Jia G, Cheng G, Gangahar DM, AGRAWAL DK. Insulinlignende vekstfaktor-1 og TNF-alfa regulerer autofagi via c-jun N-terminal kinase og Akt-veier i humane aterosklerotiske vaskulære glatte celler. Immunolcellebiol. (2006) 84:448–54. doi: 10.1111 / j.1440-1711. 2006. 01454.x
PubMed Abstrakt | CrossRef Fulltekst / Google Scholar
16. Grabner R, Lotzer K, Dopping S, Hildner M, Radke D, Øl M, et al. Lymfotoksin beta reseptor signalering fremmer tertiær lymfoid organogenese i aorta adventitia av alderen ApoE – / – mus. J Exp Med. (2009) 206:233–48. doi: 10.1084 / jem.20080752
Kryssref Fulltekst | Google Scholar
17. Damas JK, Smith C, Oie E, Fevang B, Halvorsen B, Waehre T, et al. Forbedret uttrykk for de homeostatiske kjemokinene CCL19 og CCL21 i klinisk og eksperimentell aterosklerose: mulig patogen rolle i plakkdestabilisering. Arterioscler Thromb Vasc Biol. (2007) 27:614–20. doi: 10.1161 / 01.ATV.0000255581.38523.7c
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Doring Y, Noels H, van der Vorst EPC, Neideck C, Egea V, Drechsler M, et al. Vascular CXCR4 limits atherosclerosis by maintaining arterial integrity: evidence from mouse and human studies. Circulation. (2017) 136:388–403. doi: 10.1161/CIRCULATIONAHA.117.027646
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Akhtar S, Gremse F, Kiessling F, Weber C, Schober A. CXCL12 promotes the stabilization of atherosclerotic lesions mediated by smooth muscle progenitor cells in Apoe-deficient mice. Arterioscler Thromb Vasc Biol. (2013) 33:679–86. doi: 10.1161/ATVBAHA.112.301162
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Lotzer K, Dopping S, Connert S, Grabner R, Spanbroek R, Lemser B, et al. Mouse aorta smooth muscle cells differentiate into lymphoid tissue organizer-like cells on combined tumor necrosis factor receptor-1/lymphotoxin beta-receptor NF-kappaB signaling. Arterioscler Thromb Vasc Biol. (2010) 30:395–402. doi: 10.1161 / ATVBAHA.109.191395
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
21. Smedbakken LM, Halvorsen B, Daissormont I, Ranheim T, Michelsen AE, Skjelland M, Et al. Økte nivåer av homeostatisk kjemokin CXCL13 i human aterosklerose-potensiell rolle i plakkstabilisering. Aterosklerose. (2012) 224:266–73. doi: 10.1016 / j.aterosklerose.2012.06.071
CrossRef Fulltekst | Google Scholar
22. J. k. s., j. K. S., J. K. S., J. k. s., j. k. s., j. k. s., j. k. s., et al. Insulinlignende vekstfaktor-1-reseptormangel i makrofager akselererer aterosklerose og induserer en ustabil plakkfenotype i apolipoprotein E-mangelfulle mus. Sirkulasjon. (2016) 133:2263–78. doi: 10.1161 / SIRKULASJONAHA.116.021805
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
23. Alexander MR, Owens GK. Epigenetisk kontroll av glatt muskelcelledifferensiering og fenotypisk veksling i vaskulær utvikling og sykdom. Annu Rev Physiol. (2012) 74:13–40. doi: 10.1146 / annurev-physiol-012110-142315
PubMed Abstrakt / Fulltekst / Google Scholar
24. Han C, Medley SC, Hu T, Hinsdale ME, Lupu F, Virmani R, et al. PDGFRbeta-signalering regulerer lokal betennelse og synergiserer med hyperkolesterolemi for å fremme aterosklerose. Nat Commun. (2015) 6:7770. doi: 10.1038 / ncomms8770
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
26. Da Ros F, Carnevale R, Cifelli G, Bizzotto D, Casaburo M, Perrotta M, et al. Targeting Interleukin-1beta Beskytter Mot Aortaaneurismer Indusert Av Forstyrret Transformerende Vekstfaktor beta Signalering. Immunitet. (2017) 47: 959-73 e9. doi: 10.1016 / j.immuni.2017.10.016
CrossRef Fulltekst | Google Scholar
27. Hu D, Mohanta SK, Yin C, Peng L, Ma Z, Srikakulapu P, et al. Arterie tertiære lymfoide organer kontrollere aorta immunitet og beskytte mot aterosklerose via vaskulær glatt muskel celle lymfotoksin beta reseptorer. Immunitet. (2015) 42:1100–15. doi: 10.1016 / j.immuni.2015.05.015
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
29. Parmel Varghese G, Folkersen L, Strawbridge RJ, Halvorsen B, Yngestad A, Ranheim T, et al. NLRP3 inflammasome uttrykk og aktivering i human aterosklerose. J Am Hjerte Assoc. (2016) 5: e003031. doi: 10.1161 / JAHA.115.003031
CrossRef Fulltekst | Google Scholar
30. de Jong RJ, Paulin N, Lemnitzer P, Viola JR, Vinter C, Ferraro B, et al. Beskyttende evne til anneksin A1 i arteriell neointima dannelse i aterosklerose-utsatt mus-kort rapport. Arterioscler Thromb Vasc Biol. (2017) 37:312–5. doi: 10.1161 / ATVBAHA.116.308744
CrossRef Fulltekst | Google Scholar
32. van Gils JM, Derby MC, Fernandes LR, Ramkhelawon B, Ray TD, Rayner KJ, et al. Neuroimmune guidance cue netrin-1 fremmer aterosklerose ved å hemme emigrasjonen av makrofager fra plakk. Nat Immunol. (2012) 13:136–43. doi: 10.1038 / ni.2205
Kryssref Fulltekst | Google Scholar
35. Tchkonia T, Zhu Y, van Deursen J, Campisi J, Kirkland JL. Cellulær senescens og senescent sekretorisk fenotype: terapeutiske muligheter. J Clin Invest. (2013) 123:966–72. doi: 10.1172 / JCI64098
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
37. M. m., M. M., Ostriker A, Lu S, Regan JN, Bagchi A, et al. Differensierte glatte muskelceller genererer en subpopulasjon av bosatt vaskulære stamceller i adventitia regulert Av Klf4. Circ Res. (2017) 120: 296-311. doi: 10.1161 / CIRCRESAHA.116.309322
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
40. Akhavanpoor M, Gleissner CA, Akhavanpoor H, Lasitschka F, Doesch AO, Katus HA, et al. Adventitial tertiær lymfoid organklassifisering i human aterosklerose. Cardiovasc Pathol. (2018) 32:8–14. doi: 10.1016 / j. karpaten.2017.08.002
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
41. MOOS MP, John N, Grabner R, Nossmann S, Gunther B, Vollandt R, et al. Lamina adventitia er det viktigste stedet for immuncelleakkumulering i standard chow-matet apolipoprotein E-mangelfulle mus. Arterioscler Thromb Vasc Biol. (2005) 25:2386–91. doi: 10.1161 / 01.ATV.0000187470.31662.fe
PubMed Abstrakt | CrossRef Fulltekst / Google Scholar
42. Mohanta SK, Yin C, Peng L, Srikakulapu P, Bontha V, Hu D, et al. Arterie tertiære lymfoide organer bidrar til medfødte og adaptive immunresponser i avansert mus aterosklerose. Circ Res. (2014) 114: 1772-87. doi: 10.1161 / CIRCRESAHA.114.301137
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
43. Buettner M, Lochner M. Utvikling Og funksjon av sekundære og tertiære lymfoide organer i tynntarmen og tykktarmen. Front Immunol. (2016) 7:342. doi: 10.3389 / fimmu.2016.00342
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
45. Srikakulapu P, Hu D, Yin C, Mohanta SK, Bontha SV, Peng L, et al. Arterie tertiære lymfoide organer kontrollere flerlags territorialized aterosklerose B-celle responser i alderen ApoE — / — mus. Arterioscler Thromb Vasc Biol. (2016) 36:1174–85. doi: 10.1161 / ATVBAHA.115.306983
CrossRef Fulltekst | Google Scholar
48. van De Pavert SA, Mebius RE. Ny innsikt i utviklingen av lymfoide vev. Nat Rev Immunol. (2010) 10:664–74. doi: 10.1038 / nri2832
Kryssref Full Tekst | Google Scholar
50. Barone F, Gardner DH, Nayar S, Steinthal N, Buckley CD, Luther SA. Stromal fibroblaster i tertiære lymfoide strukturer: et nytt mål i kronisk betennelse. Front Immunol. (2016) 7:477. doi: 10.3389 / fimmu.2016.00477
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
51. S. a., S. A., Lattmann E, S. A., S. A., S. A., Et al. Restaurering av lymfoid organintegritet gjennom samspillet mellom lymfoid vev-inducerceller med stroma I t-cellesonen. Nat Immunol. (2008) 9:667–75. doi: 10.1038 / ni.1605
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
52. M, Feldmann K, Gothert JR, Dick LS, Homann S, Klatt C, et al. Deficiency in lymphotoxin beta receptor protects from atherosclerosis in apoE-deficient mice. Circ Res. (2015) 116:e57–68. doi: 10.1161/CIRCRESAHA.116.305723
PubMed Abstract | CrossRef Full Text | Google Scholar
53. Guedj K, Khallou-Laschet J, Clement M, Morvan M, Gaston AT, Fornasa G, et al. M1 macrophages act as LTbetaR-independent lymphoid tissue inducer cells during atherosclerosis-related lymphoid neogenesis. Cardiovascular research. (2014) 101:434–43. doi: 10.1093/cvr/cvt263
PubMed Abstract | CrossRef Full Text | Google Scholar