26. oktober 2020, AV NCI-Ansatte
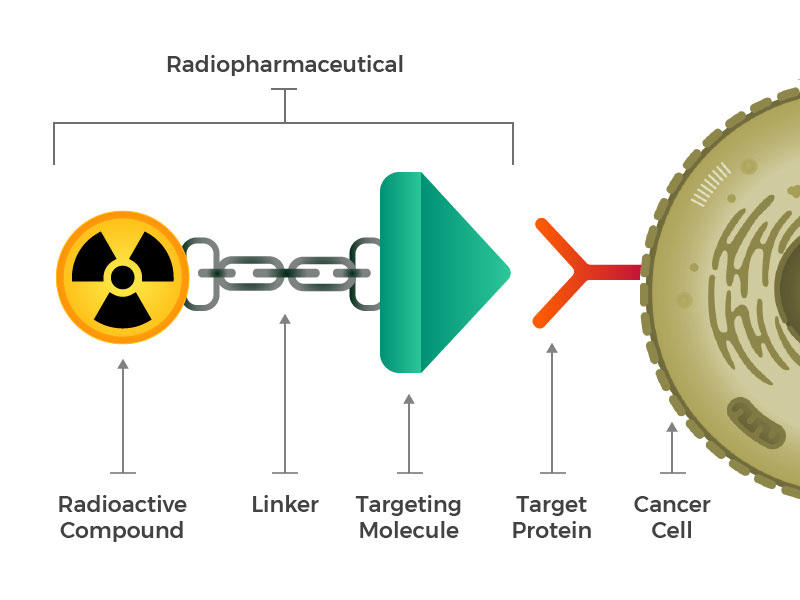
Radiofarmaka består av et radioaktivt molekyl, et målretting molekyl, og en linker som forbinder de to.
De siste to tiårene har ført til en sjøendring i måten mange typer kreft behandles på. Målrettede terapier slår ned spesifikke proteiner i kreftceller som hjelper dem å vokse, dele og spre seg. Immunotherapies stimulere eller undertrykke kroppens immunsystem til å bekjempe kreft. Men langvarige behandlinger-kirurgi, kjemoterapi og strålebehandling — forblir ryggraden i behandlingen for de fleste kreftformer.
Strålebehandling ble først brukt til å behandle kreft for mer enn 100 år siden. Omtrent halvparten av alle kreftpasienter får det fortsatt på et tidspunkt under behandlingen. Og inntil nylig ble de fleste strålebehandling gitt mye som det var 100 år siden, ved å levere stråler av stråling fra utsiden av kroppen for å drepe svulster i kroppen.
selv om det er effektivt, kan ekstern stråling også forårsake sikkerhetsskade. Selv med moderne strålebehandlingsutstyr, «du må normalt vev for å komme til en svulst,» Sa Charles Kunos, Md, Ph. D., AV NCIS Cancer Therapy Evaluation Program (CTEP). De resulterende bivirkningene av strålebehandling avhenger av området av kroppen behandlet, men kan omfatte tap av smak, hudforandringer, hårtap, diare, og seksuelle problemer.
nå utvikler forskere en ny klasse medikamenter kalt radiofarmaka, som leverer strålebehandling direkte og spesifikt til kreftceller. De siste årene har sett en eksplosjon av forskning og kliniske studier som tester nye radiofarmaka.
disse studiene har antydet at målretting av strålebehandling på mobilnivå har potensial til å redusere risikoen for både kort-og langsiktige bivirkninger av behandlingen, samtidig som selv små forekomster av kreftceller blir drept i hele kroppen.
» jeg tror de kommer til å forvandle stråling onkologi i de neste 10 til 15 årene,» Dr. Kunos sa.
Å Bygge På En Naturlig Affinitet
Å Levere stråling direkte til celler er ikke i seg selv en ny tilnærming. En slik terapi, kalt radioaktivt jod, har blitt brukt til å behandle noen typer skjoldbruskkreft siden 1940-tallet. Jod akkumuleres naturlig i skjoldbruskceller. En radioaktiv versjon av elementet kan produseres i laboratoriet. Når det tas inn (som en pille eller væske), akkumuleres det i og dreper kreftceller igjen etter skjoldbruskkirurgi.
en lignende naturlig affinitet ble senere utnyttet for å utvikle legemidler til å behandle kreft som har spredt seg til beinene, for eksempel radium 223 diklorid (Xofigo), som ble godkjent i 2013 for å behandle metastatisk prostatakreft. Når kreftceller vokser i beinet, forårsaker de beinvevet de invaderer for å bryte ned. Kroppen forsøker deretter å reparere denne skaden ved å erstatte det beinet – en prosess som kalles beinomsetning.
det radioaktive elementet radium «ser ut som et kalsiummolekyl, så det blir innlemmet i områder av kroppen der beinomsetningen er høyest,» for eksempel områder hvor kreft vokser, forklarte Dr. Kunos. Radium er da i stand til å drepe nærliggende kreftceller.
disse radioaktive forbindelsene reiser alle til kreftceller uten hjelp. Forskere lurte på om det ville være mulig å konstruere nye radioaktive molekyler som spesifikt retter seg mot andre kreftformer.
de så for seg konstruerte radiofarmaka som består av tre hovedbyggesteiner: et radioaktivt molekyl, et målrettingsmolekyl (som gjenkjenner og låser spesifikt på kreftceller), og en linker som knytter seg til de to. Slike forbindelser kan injiseres, infunderes, inhaleres eller inntas, og deretter komme seg inn i blodet.
ideen om å knytte et kreftmålrettet molekyl med et molekyl som dreper kreftceller er heller ikke nytt. For eksempel, flere stoffer som kalles antistoff-narkotika konjugater, der et antistoff som binder seg til bestemte kreftceller er knyttet til et giftig stoff, har blitt godkjent for behandling av kreft.
men arbeidet med å lage slike legemidler har møtt med begrenset suksess, Forklarte Dr. Kunos, Fordi Det ikke er nok at giftstoffer bringes nær en kreftcelle. Giftene må tas inn og holde seg inne i cellene lenge nok til å forårsake skade. Mange kreftceller har eller utvikle mekanismer for å bare pumpe giftstoffer rett ut igjen før det kan skje.
Radiofarmaka fungerer også best når stoffene kan komme inn i celler. Men det er ikke nødvendig for dem å være effektive. Når et radiofarmaka har fast til en kreftcelle, bryter den radioaktive forbindelsen naturlig ned. Dette forfallet frigjør energi som ødelegger DNA i nærliggende celler. OG NÅR en celles DNA er uopprettelig skadet, dør den cellen. Kreftceller er spesielt følsomme for strålingsindusert DNA-skade.
Avhengig av hvilken type radioaktiv forbindelse som brukes, kan den resulterende energien trenge inn i cellen bundet til radiofarmaka, så vel som om lag 10 til 30 celler som omgir den cellen. Dette øker antall kreftceller som kan drepes med et enkelt radiofarmasøytisk molekyl.
Ved midten av 2010-tallet hadde Food And Drug Administration (FDA) godkjent to radiofarmaka som målretter molekyler på visse b-celler for å behandle noen mennesker med ikke-Hodgkin lymfom, en type blodkreft. Men disse stoffene ble aldri allment vedtatt. Få leger som behandlet pasienter med lymfom ble opplært til å administrere disse typer radioaktive forbindelser. Og radiofarmaka møtte konkurranse fra nyere, ikke-radioaktive stoffer.
spillveksleren for feltet kom i 2018, Sa Jacek Capala, Ph. D., AV NCIS Strålingsforskningsprogram, da FDA godkjente lutetium Lu 177 – Dotatate (Lutathera) for behandling av visse kreftne nevroendokrine svulster (Garn) som påvirker fordøyelseskanalen.
«Dette viste at solide svulster også kan målrettes på denne måten,» med et radiofarmaka bygget fra bunnen av, sa han. I dette tilfellet er målene visse hormonreseptorer som finnes i overflod på OVERFLATEN AV NETTCELLER.
Lutetium Lu 177-dotatate var bedre til å bremse NETTOVEKSTEN enn noe tidligere stofftestet, forklarte Aman Chauhan, Md, Fra University Of Kentucky, som leder flere nye kliniske studier av stoffet. «Dette var et stort skritt fremover for vårt felt,» sa han.
Tilpasning Av Legemidler Fra Bildeforbindelser
Forskere designer og tester nå radiofarmaka for en rekke kreftformer så forskjellige som melanom, lungekreft, kolorektal kreft og leukemi, Sa Dr. Capala. Enhver svulst som har et målrettet molekyl på overflaten av cellene og en god blodtilførsel-tilstrekkelig til å levere medisiner-kan potensielt behandles med radiofarmaka, la Dr. Chauhan.
Mange av disse nyere stoffene er re-konstruerte versjoner av eksisterende forbindelser som brukes til kjernefysisk avbildning. Kjernefysiske imaging tester, for eksempel positronemisjonstomografi (PET), bruker noen ganger svake radioaktive forbindelser knyttet til molekyler som binder seg til bestemte mål på overflaten av kreftceller. Spesialiserte kameraer kan da avsløre selv små forekomster av kreftceller, noe som bidrar til å måle spredning av kreft gjennom kroppen.
Forskere har nå repurposed disse målrettingsmolekylene for å bære mer potente radioaktive forbindelser, eller isotoper, i stedet-de som kan drepe kreftceller i stedet for bare å hjelpe visualisere dem.
Prostatakreft har vært en tidlig testarena for denne repurposing. Et protein som kalles PSMA finnes i store mengder-og nesten utelukkende-på prostataceller. Ved å fusjonere et molekyl som binder SEG TIL PSMA til en radioaktiv forbindelse som brukes I PET-skanning, har forskere vært i stand til å visualisere små forekomster av prostatakreft som er for små til å bli oppdaget ved konvensjonell bildebehandling.
Flere radiofarmaka behandlinger som er rettet MOT PSMA blir nå testet i kliniske studier.
de fleste prostatakreft er svært følsomme for stråling, og ekstern stråling er ofte brukt til å behandle sykdommen, forklarte Frank Lin, Md, AV NCIS Senter For Kreftforskning, som leder en klinisk studie av EN PSMA-rettet radiofarmasøytisk VED NIH Clinical Center.
de fleste menn som mottar stråling som sin første behandling, vil ikke oppleve tilbakefall av kreft. Men hvis de gjør det, sprer det seg noen ganger i hele kroppen, med mange små forekomster av kreftceller i mange organer, forklarte han.
» når svulsten har spredt seg slik, kan du egentlig ikke gjøre ekstern strålestråling lenger, fordi ekstern stråling bare kan fokuseres på og behandle en liten del av kroppen din om gangen,» Sa Dr. Lin.
Å Ha et radiofarmaka som retter SEG mot PSMA, er en bedre måte Å gi stråling i disse tilfellene, fordi det kan infunderes direkte i blodstrømmen og sirkulere mye, og festes til prostatakreftceller som har spredt seg gjennom hele kroppen, forklarte han.
Og en stor fordel ved å ha avbildnings-og behandlingsmolekyler som bruker samme mål, er at bildebehandling kan gi leger en sniktitt på om behandlingen sannsynligvis vil fungere, la Dr. Lin til.
for Eksempel, i dr. Lins forsøk, må menn ha EN PET-skanning med bildeversjonen av forbindelsen før behandling. Hvis avbildningsforbindelsen finner veien til kreftcellene og oppdages PÅ PET-skanningen, kan forskerne anta at den tilsvarende radiofarmasøytiske behandlingen vil treffe sitt mål.
» denne komplementære utviklingen av diagnostikk hånd i hånd med narkotikabehandlinger gjør dette feltet så mye mer spennende,» sa Dr. Chauhan. «På denne måten kan vi vite at vi leverer terapien rett til tumorcellene.»
Flytter Til Kombinasjonsbehandlinger
mens radiofarmaka har vist løfte i tidlige studier, er de også, som det er tilfelle med andre typer kreftmedisiner, usannsynlig å tørke ut en svulst alene.
for eksempel, lutetium Lu 177-dotatate mer enn doblet antall personer som hadde sine nevroendokrine svulster krympe etter behandling, men at antallet var fortsatt beskjeden: ca 17%, opp fra 7% uten stoffet, forklarte Dr. Chauhan.
» det er fortsatt betydelig rom for forbedring, » sa han.
bruk av radiofarmaka i kombinasjon med andre terapier kan være en måte å drive denne forbedringen på. Noen forskere tester nå radiofarmaka kombinert med strålingssensibilisatorer-legemidler som gjør kreftceller enda mer utsatt for stråling. For eksempel leder Dr. Chauhan en klinisk studie av lutetium Lu 177-dotatat kombinert med en strålingssensibilisator kalt triapin, som blokkerer celler fra å produsere forbindelsene som trengs for DNA-reparasjon etter strålingsinducert skade.
I en annen studie tester Dr. Lin lutetium Lu 177-dotatat med en type stoff som kalles EN PARP-hemmer. Disse stoffene, som allerede er godkjent for å behandle noen typer bryst, eggstokkreft og andre kreftformer, blokkerer PROSESSEN MED DNA-reparasjon selv. «Så strålingen ville forårsake DNA-skade, OG PARP-inhibitoren ville forhindre at tumorcellene heler SITT DNA etter strålingen,» forklarte han.
Andre forskere kombinerer radiofarmaka med immunterapi for å prøve å øke effektiviteten av disse stoffene. «Nylige studier har vist at radiofarmaka kan gjøre svulster mer responsive mot immunterapi,» Sa Dr. Capala.
Mange svulster er «kalde» svulster, forklarte han, ved at immunceller ikke gjenkjenner dem, eller ikke fungerer ordentlig i mikromiljøet rundt svulster, forklarte han.
men når stråling dreper kreftceller, kan proteiner og DNA fra disse cellene spyle inn i blodet for immunceller å se, noe som kan tillate immuncellene å gjenkjenne og drepe andre kreftceller i hele kroppen. Strålebehandling kan også gjøre svulstmikromiljøet mer gjestfritt mot immunceller, la Dr. Capala.
Sammen kan disse effektene gjøre en kald svulst til en «varm» svulst: en som har en overflod av immunceller og kan være lydhør overfor immunterapi. Noen studier har forsøkt å bruke ekstern stråling for å skape denne typen respons.
» men det er data som tyder på at det fungerer bedre hvis hver svulst, hver metastase, blir utsatt for stråling. Så radiofarmasøytisk terapi har en fordel der, ved at når den er i kroppen, når den alle metastaser, » Forklarte Dr. Capala.
det kan til og med være fornuftig å kombinere radiofarmaka med ekstern stråling, så lenge nøye behandlingsplanlegging kan sikre en sikker samlet strålingsdose, la Dr. Capala til. «Ekstern strålebehandling er veldig god til å målrette mot store svulster, og da kan du kombinere den med radiofarmasøytisk terapi for å målrette metastaser,» sa han.
Utfordringer Og Advarsler
feltet av radiofarmaka er fortsatt i sine tidlige dager. En utfordring tilnærmingen må overvinne før den kan brukes i større grad, er mangelen på leger som er opplært til å administrere slike legemidler.
«antallet nukleærmedisinske leger i USA er lite,» sa Dr. Lin, som har opplæring i både nukleærmedisin og medisinsk onkologi. «Og jeg tror vi bare trener kanskje 70 eller 80 nye mennesker i året.»
Så langt har denne arbeidsstyrkemangel holdt radiofarmaka fra å leve opp til sitt sanne potensial som en personlig behandling, forklarte Dr. Capala. Det potensialet gjenspeiler det faktum at leger, i motsetning til andre typer kreftmedisiner, kan bruke bildebehandling til å måle nøyaktig hvor mye av et radiofarmaka som har nådd en svulst, nesten i sanntid, og justere dosen tilsvarende.
men denne typen behandlingsplanlegging krever tverrfaglig kompetanse som ikke er allment tilgjengelig og har forlatt folk som bruker radiofarmaka mer som «radioaktiv kjemoterapi», med en dose som passer til alle, la han til. «Dette betyr at mange pasienter ikke får optimal behandling,» Sa Dr. Capala.
Langsiktige sikkerhetsstudier er også nødvendig, la Dr. Chauhan. Personer behandlet med ekstern strålebehandling kan oppleve noen bivirkninger, kalt sene effekter—for eksempel utvikling av andre kreftformer-måneder eller år etter behandling. Selv om forskning hittil ikke har vist en høy grad av sen effekt fra radiofarmasøytisk behandling, «disse er veldig nye agenter, og vi må fortsette å være forsiktige og overvåke dem,» sa han.
Utjevning Av Samarbeid
fordi disse stoffene er relativt nye, selv med forsøkene i gang, «vi skraper bare overflaten av stoffutvikling for radiofarmaka,» Sa Dr. Chauhan.
I 2019 lanserte NCI Radiopharmaceutical Development Initiative (RDI) for å øke lovende nye legemidler til klinisk testing.
EN TING NCI håper å oppnå MED RDI er å megle flere forsøk ved hjelp av kombinasjoner av legemidler produsert av forskjellige farmasøytiske selskaper som kanskje ikke samarbeider ellers, forklarte Dr. Kunos, som leder initiativet. Bekymringer om intellektuell eiendom og mangel på tillit kan stoppe slike prosjekter før de starter, Forklarte Dr. Kunos.
» Disse typer samarbeid ville ikke nødvendigvis skje med MINDRE NCI var den ærlige megleren i midten,» sa han. Akkurat nå, bare ca 2% av tidlig fase studier støttet AV NCI tester radiofarmaka, men MED RDI dette kan vokse eksponentielt i de kommende årene, la han til.
«Vi kommer ikke til å eliminere maskiner eller andre teknikker som vi bruker i strålebehandling,» Dr. Kunos sa. «Men med deres målrettede natur tror vi at radiofarmaka skal forandre hvordan vi bruker stråling.»