Calmodulin
dette er en video introduksjon til kalsium signalering protein, calmodulin,fra en uorganisk kjemiker perspektiv!
Calmodulin, Eller CaM, Er et polypeptid som er allestedsnærværende i alle eukaryote celler. Dette proteinet er kjent som calmodulin fordi det er et kalsiummodulert protein som spiller en viktig rolle i prosessen med kalsiumsignaltransduksjon. Kalsiumsignaltransduksjon er prosessen der samspillet mellom kalsiumioner og mange proteiner formidler kommunikasjon mellom celler. calmodulins funksjon er derfor nødvendig i alle eukaryote celler, og noen av oppgavene som det bidrar til å oppnå er nervesignalering, skjelettmuskulaturbevegelse og minne. Ved å registrere kalsiumioner i miljøet, aktiverer calmodulin og fungerer deretter som et mellomprodukt, initierer bindingen av viktige proteiner som kinaser, og hjelper cellene våre i grunnleggende og sofistikert funksjon («Calmodulin»).
videoen nedenfor viser den strukturelle endringen som skjer innen CaM under kalsiumbinding(PDB-koder 3CLN og 1CFD).
proteinet i seg selv er 148 aminosyrer i lengde med to globulære regioner som inneholder 2 EF-håndmotiver hver, som er karakteristiske steder for kalsiummedierte polypeptider. Når aktivert, inneholder calmodulin 4 Ca2 + – ioner som drastisk endrer proteinets form. Når calmodulin binder seg med kalsiumioner, åpner proteinet fra sin apo-form til sin haloform, og utsetter en alfa-helix som er kjent som linker eller central tether-regionen. Laget for sin fleksibilitet, er den sentrale tether-regionen plasseringen av proteinet som partnerproteiner binder og bidrar til kaskaden som er den sekundære meldingen av kalsium. Basert på strukturen og behovet for kalsiumioner for å fungere, må calmodulin kunne velge kalsiumioner i cytoplasma, og samspillet mellom ion og ligander i EF-hånddomenene støtter denne ideen om selektivitet (Bertini et. al., 635-638).
dette bildet er en skildring av HVORDAN ET EF-håndmotiv ligner en hånd. Båndet diagrammet til venstre viser en av de fire karakteristiske helix-turn-helix EF hånd motiver av calmodulin. (PDB kode 3CLN)
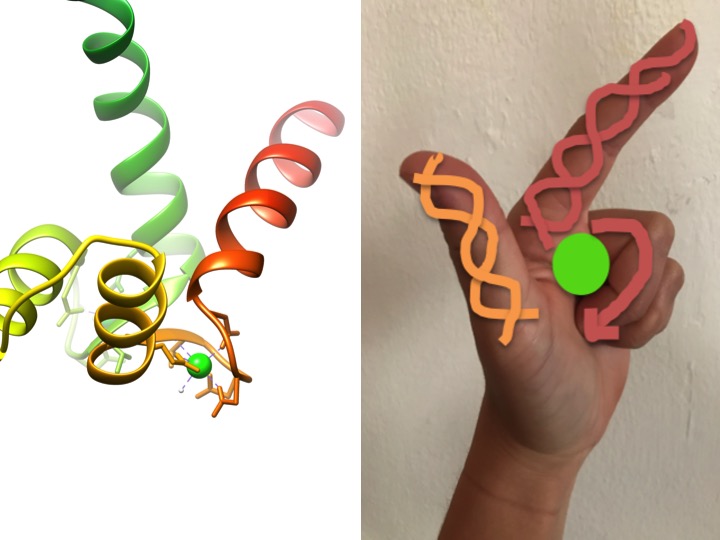
EF – hånd motiver er svært konserverte strukturelle regioner av proteiner involvert i binding av kalsium. Disse områdene er kjent som» hånd » -motiver fordi de ligner en hånd som er laget I form Av En L, hvor metallionen befinner seg midt i knyttneve, alfa-heliksene er indikert av den oppadgående pekefingeren og innovervendt tommelen, og de krøllede fingrene representerer sving-eller løkkeområdet. Dette er demonstrert i figuren ovenfor. I et karakteristisk EF-håndmotiv binder aminosyrer inkludert glutamater, asparaginer, asparaginsyrer og glutaminsyrer Til Ca, så vel som vann (Bertini et . al. 639). Den typiske ef-hand domain bonding-sekvensen er vist i figuren nedenfor.
denne tegneserien illustrerer de koordinerte aminosyrene i et TYPISK ef-hånddomene (den nøyaktige aminosyresammensetningen varierer!). Den stiplede linjen representerer koordinering Av Ca til oksygen av en ryggrad karbonyl, mens faste linjer indikerer koordinering til sidekjeder eller vann.
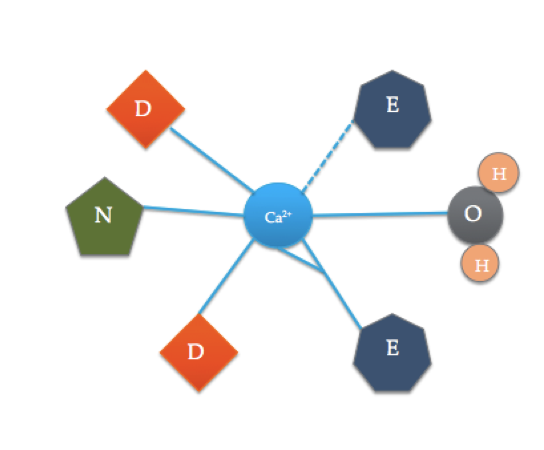
calmodulinbindingsstedet er noe annerledes enn DET mest typiske ef-hånddomenet som er vist ovenfor. De 6 ligandene av calmodulin inkluderer sidekjedene av tre asparagasyrer (D), 1 glutaminsyre (E) som danner to koordinatkovalente bindinger med ion, 1 vannmolekyl fra løsning og 1 karbonylmolekyl fra ryggraden. Bindingsstedet til calmodulin består av En Ca2 + ion omgitt av 6 ligander mens den danner 7 bindinger.
MAN kan legge merke TIL AT EF-motivet i calmodulin inneholder mange av de samme ligandene, bare på forskjellige steder. Denne konformasjonen kan gi en ide om hvorfor calmodulin er selektiv for kalsium og hvordan bare tilstedeværelsen av kalsiumion kan tilfredsstille bindingsstedet som får proteinet til å aktivere. Dette er relatert til termodynamikken til calmodulin i cellen og hvordan den reagerer på tilstedeværelsen av kalsiumioner.
for å forstå termodynamikken som parrer aktiveringen av calmodulin, må man først forstå konsentrasjonen av ioner som kalsium og magnesium i en eukaryotisk celle, inkludert den av et menneske. Konsentrasjonen av disse ionene må være nøye regulert. Innenfor i cellen er kalsiumsignalering ledsaget av en midlertidig økning i konsentrasjonen av kalsiumioner, som er sensert av proteiner som calmodulin (Bertini et. al., 636). Denne kalsiumbølgen kan skyldes intracellulære G-proteiner som induserer det grove og glatte retikulumet for å frigjøre kalsium, eller kalsiumioner kan bringes inn fra det ekstracellulære rommet. I tilfelle av calmodulin reagerer det vanligvis på kalsium som bringes inn i cellen fra utsiden, som oppstår under prosesser som nervesignalering (Bertini et. al. 637). Før kalsiumkonsentrasjonen økes øyeblikkelig, er konsentrasjonen i cellen vanligvis mellom 10-100 nm, mens konsentrasjonen øker til 1.000-100.000 nm under den korte tilstrømningen av ioner. Endringen i konsentrasjon får calmodulin til å fornemme kalsiumioner, binde dem og initiere ytterligere signaltransduksjon (Bertini et. al., 635).
hvordan binder calmodulin endelig kalsiumioner og ikke for eksempel magnesiumioner? Mg2 + – ioner er faktisk ganske lik kalsiumioner: de ville engasjere seg i elektrostatiske interaksjoner i stedet for kovalente, og de regnes som harde atomer. Grunnen til at calmodulin ser ut til å favorisere kalsiumioner i stedet for magnesiumioner, er relatert til bindingskonstantene til hver ion. Calmodulin kan eksistere mens det er bundet til andre ioner, for eksempel magnesium, men hvis det er en høyere konsentrasjon av kalsium, vil kalsiumioner umiddelbart konkurrere ut magnesiumioner for å okkupere kalsiumbindingssteder. Dette skyldes at bindingskonstanten Til CaM Og Ca2 + (Ka) er større enn CaM og Mg2+, som vist i Figur 7. Dette indikerer at når det er bundet til kalsiumioner, vil calmodulin produsere flere produkter. Man må vurdere alle disse ideene med tanke på at denne prosessen skjer utallige ganger per sekund, og omsetningen av dette proteinet endres for å reagere på den stadig modulerte kalsiumkonsentrasjonen av cellen.
hvorfor er calmodulinbinding med kalsiumioner gunstigere enn med andre metaller? Det kan være på grunn av størrelsen på ioner i forhold til sterisk hindring indusert av ligander. Bindingsstedet er preget av 6 ligander som gjør 7 koordinatbindinger. Fordi kalsiumioner er større enn magnesiumioner, som vist i Figur 8, er det mulig at kalsium er favorisert fordi det øker avstanden til ligandene fra hverandre, og dermed reduserer steriske interaksjoner mellom ligandene. Selve strukturen av proteinet selv kan også utgjøre en grunn for selektiviteten av kalsiumioner. Samlet sett er det kjent at på grunn av termodynamikk basert på varierende cellulær konsentrasjon av kalsiumioner, vil calmodulin fornemme økningen av ioner, binde dem og bidra til å utføre sin funksjon.
CaM + Ca2+<–> Ca2+CaM (KCaM-Ca)
CaM + Mg2+<–> Mg2+CaM (KCaM-Mg)
Mg2+-CaM + Ca2+<–> Ca2+CaM + mg2+
fordi kcam-Ca> Kcam-Mg
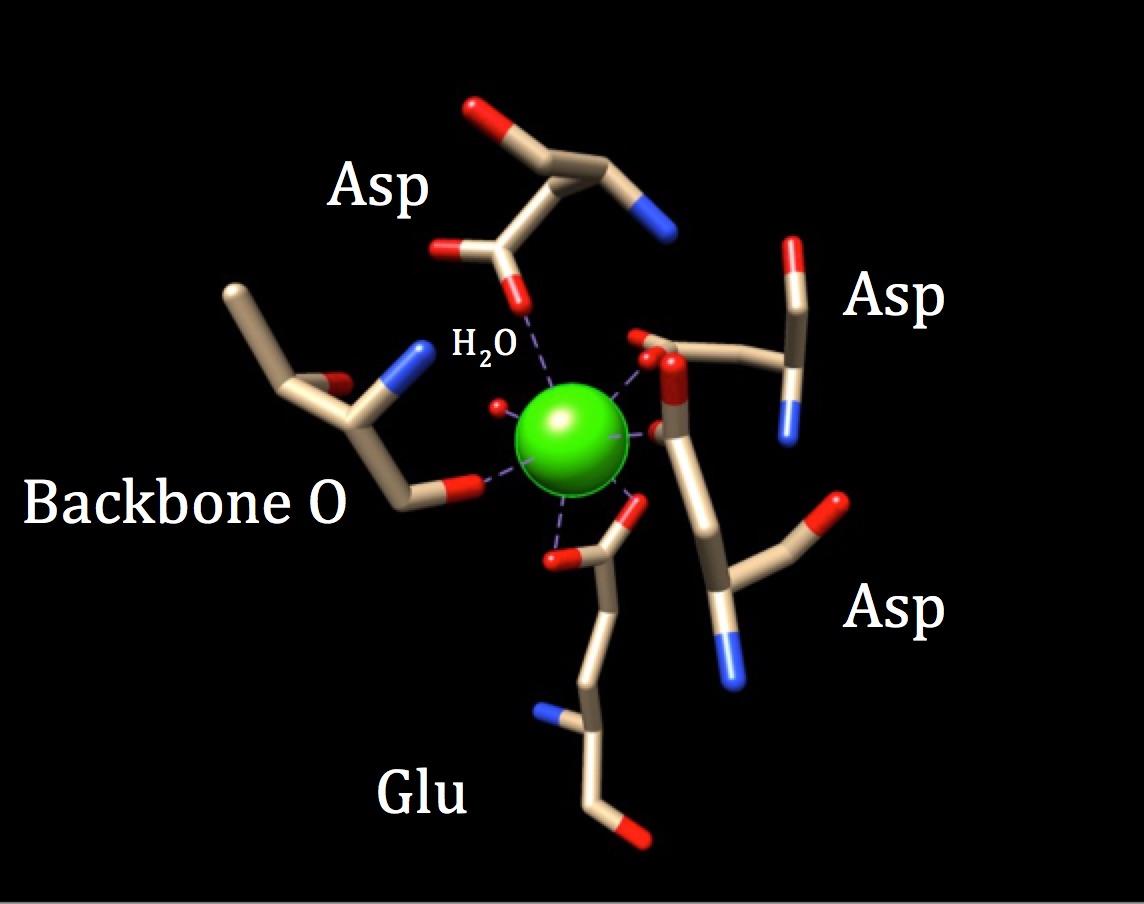
I En Videre Diskusjon Av Kjemien Til Bindingsstedet Til Calmodulin, Bør Koordinasjonsgeometrien Utforskes. Fordi kalsiumionet interagerer med syv donoratomer, er systemet kjent som et heptadentatsystem. Fordi calmodulin er omgitt av seks ligander, ville man anta en oktaedisk koordinasjonsgeometri. Men fordi en av ligandene interagerer på en bidentat måte med ion—noe som betyr at den har to koordinatkovalente bindinger som kommer fra forskjellige atomer i en aminosyre-koordinasjonskomplekset tar en forvrengt oktaedisk form. Den spesifikke koordinasjonen er skissert i figuren nedenfor.
koordinasjonsgeometrien til calmodulins kalsiumbindingssted. Senteret kalsium metall ion er omgitt av tre asparaginer (Asp), en ryggrad oksygen, en gluatminsyre (Glu) og ett vannmolekyl. (PDB kode 3CLN)
vi kan også referere til teorien om chelateffekten for bedre å forstå calmodulins evne til å binde seg til metallioner med høy affinitet. En chelator er et atom som er i stand til å binde med mer enn ett donoratom. Polydentatbinding er relatert til chelateffekt, som sier at når en ligand binder seg med mange donorgrupper (poly), er koordinatkovalente bindinger mye sterkere eller tettere holdt. Denne teorien støttes av termodynamikk, spesielt at polydentatbinding øker entropien til et system, noe som gjør det mer positivt (mer lidelse), som er termodynamisk gunstig. Bruk av denne teorien til calmodulin bidrar til å forklare ikke bare betydningen av polydendatbindingen i selve områdene, men også behovet for at proteinet binder 4 forskjellige kalsiumioner for å aktivere funksjonen. Ved å kreve binding av fire Ca2 + – ioner innenfor områdene, oppfordrer systemet til en økning i entropi ved å introdusere flere substrater / reaktanter for å danne et større antall produkter. Dette skjer på grunn av det høyere antall bindinger i ligandinteraksjonene til hvert bindingssted. Alt i alt støttes bindingen av kalsiumionet i polypeptidets steder av chelateffektteorien og kaster lys over calmodulins effektivitet i bindende kalsium.
EF – håndmotiver har en viss struktur basert på at kalsium er det sentrale metallet. Dette gjelder også for calmodulin-bindende nettsteder. Ca2 + ion binder seg med lignende atomer i strukturer av visse aminosyrer basert på en teori som kalles Hard / Myk Syre-Base Teori. Denne teorien skiller metaller og ligander i to kategorier basert på polariserbarheten og deres ladning til radiusforhold. Harde syrer og baser er mindre ioner som har et større forhold mellom ladning og størrelse, og dette fører dem til å samhandle på elektrostatiske måter (som betyr attraksjoner mellom + og-ladninger), mens myke syrer og baser er større i størrelse og derfor har et mindre forhold mellom ladning og radius, noe som fører dem til å lage bindinger med kovalent karakter. Uttrykket «som binder med som» refererer til det faktum at harde syrer og baser har en tendens til å samhandle med andre harde atomer, og det samme gjelder for myke syrer og baser. Ca2 + er karakterisert som en hard syre fordi, selv om den har en stor radius, interagerer den med ligander på en mest elektrostatisk måte. Når man ser på kalsiumbindingsstedet til calmodulin, kan man se at kalsiumionet binder seg til oksygenatomer av 3 asparaginsyrer, glutaminsyre, vann og ryggradskarbonyl. Denne bindingen er i tråd med «like binder med like» fordi vann og aminosyrene ligander, glutaminsyre og asparaginsyre, binder gjennom oksygendonorer som er karakterisert som harde baser. Figur 10 revisits bindingsstedene calmodulin samtidig viser de negative sidekjeder av aminosyrer som ville samhandle med kalsiumioner betegnet i blått.
Når det gjelder donoratomer i de bundne ligander og deres evne til å donere elektronpar til koordinasjonskomplekset, forklarer den spektrokjemiske serien hvordan atomene samhandler med det sentrale metallet. Når det gjelder kalsiumbindingsstedet, er oksygenene som interagerer Med Ca2+-ion alle ansett som σ-givere og π-givere fordi donoroksygenene har 2 eller flere par elektroner. Kategoriene av de spektrokjemiske seirene som spesifiserer elektrontilgjengelighet og donasjon har implikasjoner på spinnbetegnelse (lav eller høy), som betegner hvordan d-elektroner fyller i sine orbitaler, og delta (Δ) størrelse mellom metallets d-orbitaler, men dette gjør ingen forskjell for kalsium fordi kalsiums d-orbitaler er ubebodd på grunn av fravær av valens d-elektroner. Dette gjør d-orbitalene i det vesentlige ubetydelige i de fleste samtaler om proteinet. Et unntak er relatert til å vurdere labiliteten av kalsiumionet i systemet.
mangelen på elektroner i Cas d-orbitaler gir null ligandfeltstabiliseringsenergi, og forklarer kalsiumionens høye labilitet. Labilitet refererer til hastigheten som ligander kan erstattes i koordinasjonskomplekser, og beskriver derfor kinetikken til et system. Atomer er labile hvis de bytter ligander raskt. På grunn av sin relevante funksjon i alle eukaryote celler, forventes calmodulin å binde og frigjøre kalsiumioner millioner av ganger per sekund for å sende og motta meldinger fra omgivende celler gjennom overføring av kalsiumioner. Når det gjelder calmodulins evne til å binde Og frigjøre Ca2+ raskt, er det viktig å vurdere belegget av valens d-elektronorbitaler. Som nevnt har kalsium tomme valens d orbitaler. Disse ubebodde orbitaler kan gi opphav til en forklaring På En Ca2+ ion labilitet. Fordi alle kalsiumionens d-orbitaler er tomme, har den en ligandfeltstabiliseringsenergi (lfse) på 0. Dette indikerer at kalsium er ustabilt når MAN vurderer LFSE på grunn av at stabile molekyler vanligvis har en negativ verdi for LFSE. Ustabilitet i dette tilfellet oversetter til en vilje til å reagere raskt og bevege seg av og på komplekser, og støtter påstanden Om At Ca2+ – ioner oppmuntrer til raske reaksjoner og kan karakteriseres som labile. Selv om dette synes å være counterintuitive til diskusjonen som involverer chelat effekt, er det forstått at disse to teoriene ikke motsier hverandre. Stabiliteten til de tettholdte koordinasjonsbindingene som foreslås av chelateffekten, oppfordrer calmodulin til å forbli stabil lenge nok til å binde supplementsproteiner. Når det er fullført og konsentrasjonen av kalsium går tilbake til normal, er det effektivt å strippe stedet for kalsiumioner.
Calmodulin, basert på dens struktur og sammensetningen av dets vitale bindingssted, spiller en integrert del av utallige prosesser utført av eukaryote celler. Gjennom aksept og binding av kalsiumioner i signaltransduksjon, fungerer calmodulin som en sentral komponent i grunnleggende og høyt nivå funksjon i organismer som mennesker. Ved å bruke bioinorganisk teori og forstå en forståelse av det delikat overvåkede miljøet til en eukaryotisk celle, kan man riktig forstå calmodulins evne til å velge kalsiumioner og oppmuntre til videre funksjon som involverer mer enn 100 partnerproteiner.