Dette innlegget ble bidratt Av Kurt Thorn Fra Nikon Imaging Center VED UCSF.
et vanlig krav for levende celle imaging eksperimenter er evnen til å følge flere fluorescently merket arter samtidig. For å gjøre det med fluorescerende protein etiketter krever flere fluorescerende proteiner som eksitasjon og utslipp spektra variere tilstrekkelig for dem å bli avbildet i forskjellige fluorescerende kanaler på mikroskopet. Med spredning av fluorescerende proteiner de siste årene er det mange fluorescerende proteinkombinasjoner som kan avbildes sammen, men dette betyr også at valget av fluorescerende proteiner krever litt tanke.

det første trinnet i å velge fluorescerende proteiner for multi-color imaging eksperiment er å være klar over hva fluorescerende proteiner er tilgjengelige. Med nye fluorescerende proteiner som publiseres hver måned, er det en utfordring å bestemme seg for det beste proteinet for en gitt applikasjon. For å holde deg oppdatert på de nyeste fluorescerende proteiner, opprettholder jeg en interaktiv graf og tabell over de beste fluorescerende proteiner som er tilgjengelige.
Velge kompatible fluorescerende proteiner
for å velge et sett med fluorescerende proteiner som skal avbildes sammen, må du vurdere de samme faktorene som når du velger et individuelt fluorescerende protein (lysstyrke, fotostabilitet og så videre; se forrige blogginnlegg for mer diskusjon av disse faktorene). I tillegg må du også velge fluorescerende proteiner som kan skille seg fra hverandre, og som kan avbildes med optikken på mikroskopet(e) du har tenkt å bruke. En nøyaktig bestemmelse av om to fluorescerende proteiner kan skilles fra hverandre krever kunnskap om deres eksitasjon og utslipp spektra, men en god tommelfingerregel er at både topp eksitasjon bølgelengder og topp utslipp bølgelengde av de to proteinene skal skilles ved 50-60 nm. FOR EKSEMPEL KAN CFP (ex 430 nm / em 474 nm) OG YFP (ex 514 nm / em 527 nm) avbildes sammen, MEN CFP og GFP (ex 488 nm / em 507 nm) viser noen crosstalk mellom de to fluorescerende proteiner. Hvis du må vise fluorescerende proteiner hvis spektra overlapper, er det teknikker, som spektral unmixing, som kan brukes til å skille fluorescerende proteiner, men disse er utenfor omfanget av dette innlegget.
er dine fluorescerende proteiner kompatible med mikroskopoptikken din?
for å avgjøre om de fluorescerende proteinene du er interessert i, er kompatible med mikroskopoptikken din, vil du sammenligne eksitasjons-og utslippsspektrene til proteinet ditt med filtersettene eller laserne på mikroskopet ditt. Ideelt sett vil du ha betydelig overlapping mellom eksitasjons-og utslippsfiltre og proteinets eksitasjons – og utslippsspekter, slik at proteinet er godt opphisset av mikroskopet ditt, og fluorescensutslipp av proteinet samles effektivt av mikroskopet. For å sammenligne kampen mellom et fluorescerende protein og et filtersett, gir mange filtersett leverandører verktøy for å plotte fluorescensspektrene av proteiner og fargestoffer og deres filtre (se Chroma, Semrock eller Omega). Selv om disse ikke inneholder alle fluorescerende proteiner i vanlig bruk (spesielt ikke de sist publiserte), kan de være et godt utgangspunkt. I mange tilfeller er det tilstrekkelig å bruke et spektrum for et nært beslektet protein, hvis du vet at ditt protein av interesse har et lignende spektrum. For eksempel, her er et skjermbilde fra Chroma Spectra Viewer som sammenligner et Standard Cy3-eller Rhodaminfiltersett (Chroma #49004) med spektrene til både mCherry og TagRFP.
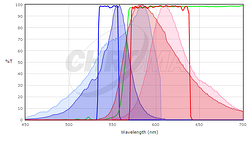
Her vises TagRFP-spekteret i mørkere farger og mCherry-spekteret vises i lysere farger; eksitasjonsspektra er blå og utslippsspektra er røde. Det er heller ikke en perfekt match til filtersettet, men eksitasjonsfilteret spenner mer av toppen Av TagRFP-eksitasjonen, og utslippsfilteret samler en større brøkdel Av tagrfp-utslipp enn mCherry-utslipp. For dette filtersettet forventer Vi TagRFP å gi et lysere signal enn mCherry. Generelt vil filtersett designet For Rhodamin / Cy3 fungere bedre med kortere bølgelengde røde fluorescerende proteiner som TagRFP eller mRuby2 enn lengre bølgelengdeproteiner som mCherry. For bakgrunn om fluorescens og filtersett, se Introduksjon Til Fluorescensmikroskopiforelesning ved iBiology.
Vanlige filtersett& relevante fluorescerende proteiner
Vanlige filtersett for flerfarget bildebehandling inkluderer de som er designet for CFP, YFP og RFP eller Sedat Quad filtersettet, designet for Dapi / Fluorescein / Rhodamin / Cy5 (F. eks. 405 / 488 / 561 / 640 nm). I våre hender er de beste fluorescerende proteinene for bildebehandling med dette settet mTagBFP2, EGFP eller en av de forbedrede gfp-variantene, mRuby2 eller TagRFP-T, og et infrarødt fluorescerende protein som iFP1.4 eller iFP2.0. Vær oppmerksom på at disse infrarøde fluorescerende proteiner krever biliverdin som en kofaktor, og du må kanskje supplere cellene med biliverdin for maksimal lysstyrke. I pattedyrceller er en av de forbedrede foldevariantene AV EGFP som mEmerald eller Clover trolig best; mNeonGreen er et enda nyere grønt fluorescerende protein som skal være ekstremt lyst. I S. cerevisiae, vi har testet en rekke grønne og røde fluorescerende proteiner med dette filtersettet og har rapportert lysstyrkemålinger. HER OVERGÅR EGFP de forbedrede foldevariantene, antagelig på grunn av lavere veksttemperatur. Dette antyder imidlertid også at det ikke er noe enkelt fluorescerende protein optimalt for alle organismer, og at hvis du vil ha det lyseste signalet, må du kanskje prøve flere proteiner i ditt interessesystem. Til slutt, i dette settet av proteiner er de grønne og røde proteinene generelt de mest påviselige, og det bør derfor brukes til å merke dine minst rikelige proteiner, med de blå og infrarøde kanalene som brukes til mer rikelige proteiner eller markeringsrom.
jeg håper dette gir litt lys på flerfarget bildebehandling med fluorescerende proteiner. Med riktig mikroskop og riktig valg av fluorescerende proteiner, bør bildebehandling fire farger samtidig være ganske grei.
Takk til Vår Gjest Blogger!
 Kurt Thorn er førsteamanuensis VED UCSF, hvor han leder Nikon Imaging Center. Han fikk Sin Doktorgrad i biofysikk FRA UCSF I laboratoriet Til Ronald Vale, hvoretter han var stipendiat Ved Bauer Center For Genomics Research Ved Harvard University. Lær mer på hans lab nettside eller hans mikroskopi blogg.
Kurt Thorn er førsteamanuensis VED UCSF, hvor han leder Nikon Imaging Center. Han fikk Sin Doktorgrad i biofysikk FRA UCSF I laboratoriet Til Ronald Vale, hvoretter han var stipendiat Ved Bauer Center For Genomics Research Ved Harvard University. Lær mer på hans lab nettside eller hans mikroskopi blogg.