elektrolity jonowe
woda i inne cząsteczki polarne są przyciągane do jonów, jak pokazano na rysunku \(\PageIndex{2}\). Przyciąganie elektrostatyczne między Jonem a cząsteczką z dipolem nazywa się przyciąganiem jonowo-dipolowym. Atrakcje te odgrywają ważną rolę w rozpuszczaniu związków jonowych w wodzie.
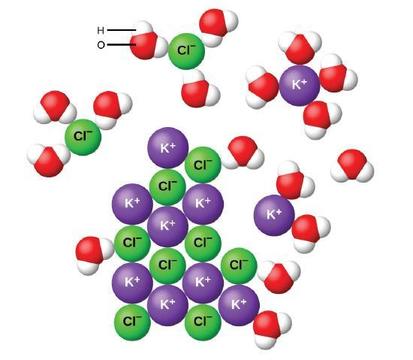
gdy związki jonowe rozpuszczają się w wodzie, jony w ciele stałym oddzielają się i rozpraszają równomiernie w roztworze, ponieważ cząsteczki wody otaczają i solwatują jony, zmniejszając silne siły elektrostatyczne między nimi. Proces ten reprezentuje fizyczną zmianę znaną jako dysocjacja. W większości warunków związki jonowe po rozpuszczeniu prawie całkowicie się dysocjują, dlatego są klasyfikowane jako silne elektrolity.
zastanówmy się, co dzieje się na poziomie mikroskopowym, gdy dodamy stały KCl do wody. Siły jonowo-dipolowe przyciągają dodatni (wodorowy) koniec polarnych cząsteczek wody do ujemnych jonów chlorkowych na powierzchni ciała stałego, a przyciągają ujemne (tlenowe) końce do dodatnich jonów potasu. Cząsteczki wody przenikają pomiędzy pojedynczymi jonami K+ i Cl− i otaczają je, zmniejszając silne siły międzyjonowe, które wiążą jony ze sobą i pozwalając im przejść do roztworu jako jony solwatowane, jak pokazano na rysunku. Redukcja przyciągania elektrostatycznego pozwala na niezależny ruch każdego uwodnionego jonu w rozcieńczonym roztworze, co powoduje wzrost zaburzeń układu, gdy jony zmieniają swoje stałe i uporządkowane pozycje w krysztale na ruchome i znacznie bardziej nieuporządkowane stany w roztworze. To zwiększone zaburzenie jest odpowiedzialne za rozpuszczanie wielu związków jonowych, w tym KCl, które rozpuszczają się wraz z absorpcją ciepła.
w innych przypadkach przyciąganie elektrostatyczne między jonami w krysztale jest tak duże, lub Siły atrakcyjne jonowo-dipolowe między jonami a cząsteczkami wody są tak słabe, że wzrost zaburzeń nie może zrekompensować energii wymaganej do oddzielenia jonów, a kryształ jest nierozpuszczalny. Tak jest w przypadku związków takich jak węglan wapnia (wapień), fosforan wapnia (nieorganiczny Składnik kości) i tlenek żelaza (rdza).