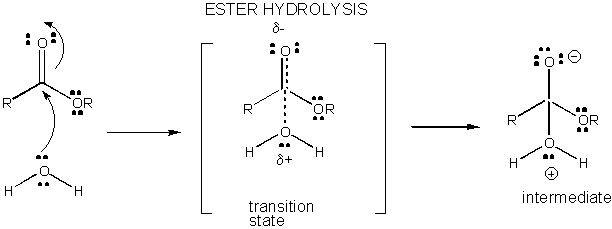
reakcje w roztworze, które nie są katalizowane, są powolne, ponieważ rozwój ładunku i separacja zachodzi w stanie przejściowym. Kiedy wiązania są tworzone lub łamane, naładowane Półprodukty są często tworzone, które są wyższe w energii niż reagenty. Ponieważ półprodukt jest wyższy w energii niż reagenty, stan przejściowy byłby jeszcze wyższy w energii,a zatem bardziej przypomina naładowany półprodukt. Wszystko, co może ustabilizować ładunki pośrednie, a tym samym ładunki rozwijające się w stanach przejściowych, obniży energię stanu przejściowego i katalizuje reakcję. W tej sekcji zbadamy mechanizm leżący u podstaw katalizy przez małe cząsteczki reakcji chemicznych. Przypuszczalnie biologiczny katalizator makromolekularny (podobnie jak enzymy białkowe) będzie używał podobnych mechanizmów w ich działaniu katalitycznym (co zostanie omówione w następnej sekcji).
katalizatory, w tym enzymy, mogą stosować co najmniej 5 różnych sposobów stabilizacji stanów przejściowych.
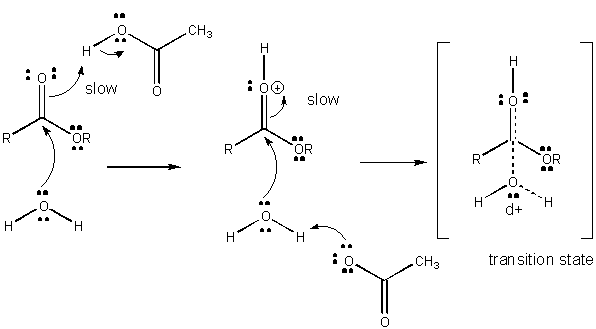
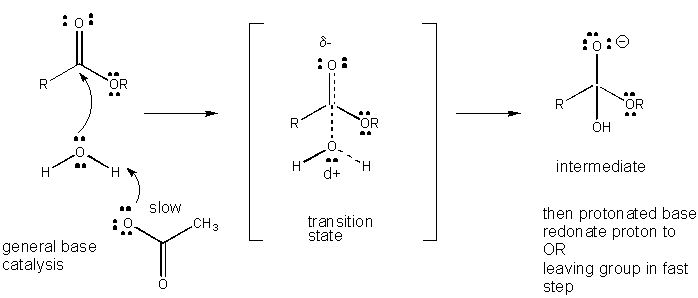
rozwój ładunku w TS można zmniejszyć poprzez oddanie protonu z kwasów ogólnych (takich jak kwas octowy lub protonowany pierścień indolowy) do atomu takiego jak karbonyl O, który rozwija częściowy ładunek ujemny w TS, gdy jest przyłączony przez nukleofil. Oddawanie protonów zmniejsza rozwijający się ujemny wynik w TS. Alternatywnie, nukleofil taki jak woda, który rozwija częściowy ładunek dodatni w TS, gdy zaczyna tworzyć wiązanie z elektrofilowym C w karbonylu, może być stabilizowany przez obecność ogólnej zasady (takiej jak octan lub zdeprotonowany pierścień indolowy). Absorbcja protonów zmniejsza rozwijający się ładunek dodatni
rysunek: rozwój ładunku w stanie przejściowym dla hydrolizy estrowej
rysunek: mechanizm ogólnej katalizy kwasowej
rysunek: mechanizm ogólnej katalizy bazowej
- Prof. Henryk Jakubowski (Kolegium św. Benedykta / St. John ’ s University)