reakcje otwarcia pierścienia epoksydowego-SN1 vs.SN2, regioselektywność i stereoselektywność
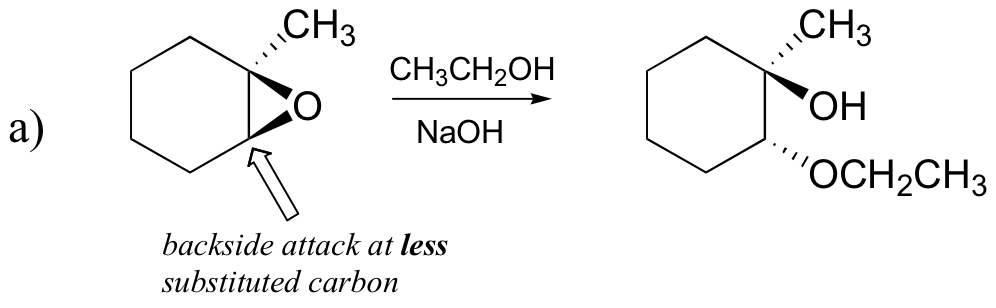
nieenzymatyczne reakcje otwarcia pierścienia epoksydów zapewniają ładny przegląd wielu pojęć, które widzieliśmy już w tym rozdziale. Reakcje otwarcia pierścienia mogą przebiegać za pomocą mechanizmów SN2 lub SN1, w zależności od rodzaju epoksydu i warunków reakcji. Jeśli epoksyd jest asymetryczny, struktura produktu będzie się różnić w zależności od tego, który mechanizm dominuje. Kiedy asymetryczny epoksyd ulega solwolizie w podstawowym metanolu, otwarcie pierścienia następuje przez mechanizm SN2, a mniej podstawiony węgiel jest miejscem ataku nukleofilowego, co prowadzi do tego, co będziemy nazywać produktem B:

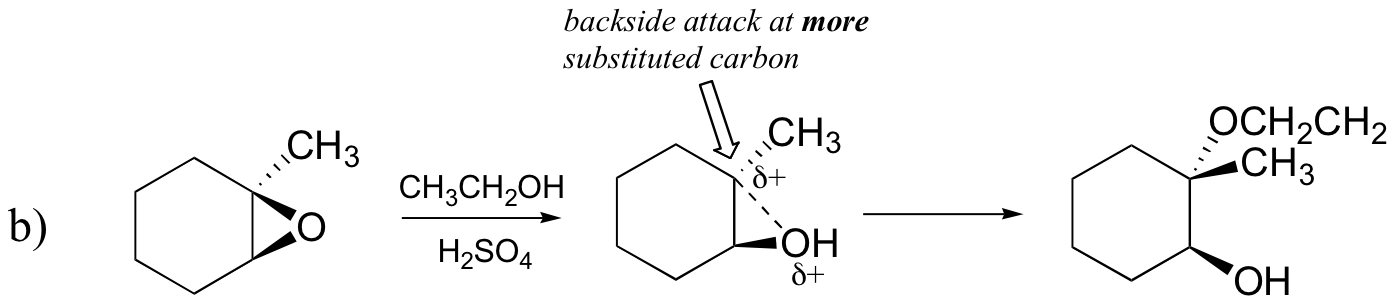
odwrotnie, gdy solwoliza występuje w kwaśnym metanolu, reakcja zachodzi za pomocą mechanizmu o znacznym charakterze SN1, a bardziej podstawiony węgiel jest miejscem ataku. W rezultacie przeważa produkt A.

są to zarówno dobre przykłady reakcji regioselektywnych. W reakcji regioselektywnej możliwe są dwa (lub więcej) różne izomery konstytucyjne jako produkty, ale jeden powstaje preferencyjnie (lub czasami wyłącznie).
zbadajmy najpierw podstawowy przypadek SN2. Grupa opuszczająca jest anionem alkoksylowym, ponieważ nie ma kwasu dostępnego do protonowania tlenu przed otwarciem pierścienia. Alkotlenek jest grupą słabo opuszczającą, a zatem pierścień jest mało prawdopodobne, aby otworzył się bez „pchnięcia” od nukleofila.

sam nukleofil jest silny: deprotonowany, Ujemnie naładowany jon metoksydowy. Gdy reakcja substytucji nukleofilowej obejmuje słabą grupę opuszczającą i silny nukleofil, jest bardzo prawdopodobne, że będzie przebiegać przez mechanizm SN2.
a co z elektrofilem? W epoksydzie znajdują się dwa elektrofilowe węgle, ale najlepszym celem dla nukleofila w reakcji SN2 jest węgiel, który jest najmniej utrudniony. Wynika to z obserwowanego wyniku regiochemicznego. Podobnie jak w innych reakcjach SN2, atak nukleofilowy odbywa się od tyłu, co skutkuje inwersją węgla elektrofilowego.
prawdopodobnie najlepszym sposobem przedstawienia katalizowanej kwasem reakcji otwierania pierścienia epoksydowego jest hybryda lub skrzyżowanie mechanizmu SN2 i SN1. Po pierwsze, tlen jest protonowany, tworząc dobrą grupę opuszczającą (Krok 1 poniżej) . Następnie Wiązanie węgiel-tlen zaczyna się łamać (Krok 2) i ładunek dodatni zaczyna gromadzić się na bardziej podstawionym węglu (przypomnijmy dyskusję z sekcji 8.4 B na temat stabilności karbokacji).

w przeciwieństwie do reakcji SN1, nukleofil atakuje elektrofilowy węgiel (etap 3), zanim dojdzie do utworzenia pełnego półproduktu karbokalizacyjnego.

atak odbywa się preferencyjnie z tyłu (jak w reakcji SN2), ponieważ Wiązanie węgiel-tlen jest nadal w pewnym stopniu na miejscu, a bloki tlenu atakują z przodu. Zauważ jednak, jak wynik regiochemiczny różni się od reakcji katalizowanej zasadą: w procesie katalizowanym kwasem nukleofil atakuje więcej podstawionego węgla, ponieważ to właśnie ten węgiel posiada większy stopień ładunku dodatniego.
ćwiczenie 8.17:
przewidzieć główny produkt (- y) reakcji otwarcia pierścienia, który występuje, gdy epoksyd przedstawiony poniżej jest traktowany:
a) etanolem i niewielką ilością wodorotlenku sodu
b) etanolem i niewielką ilością kwasu siarkowego

Wskazówka: pamiętaj, aby wziąć pod uwagę zarówno regiochemię, jak i stereochemię!
filmy Khan academy

otwarcie pierścienia w warunkach kwaśnych: