this post was contributed by Kurt Thorn of the Nikon Imaging Center at UCSF.
powszechnym wymogiem dla żywych eksperymentów obrazowania komórek jest zdolność do śledzenia wielu fluorescencyjnie oznakowanych gatunków jednocześnie. Aby to zrobić za pomocą fluorescencyjnych etykiet białkowych, wymaga wielu fluorescencyjnych białek, których widma wzbudzenia i emisji różnią się wystarczająco, aby można je było zobrazować w różnych kanałach fluorescencyjnych mikroskopu. Wraz z rozprzestrzenianiem się fluorescencyjnych białek w ostatnich latach istnieje wiele fluorescencyjnych kombinacji białek, które mogą być obrazowane razem, ale oznacza to również, że wybór fluorescencyjnych białek wymaga zastanowienia.

pierwszym krokiem w wyborze białek fluorescencyjnych do wielokolorowego eksperymentu obrazowania jest świadomość tego, jakie białka fluorescencyjne są dostępne. Z nowych białek fluorescencyjnych publikowane co miesiąc, decydując się na najlepsze białko dla danego zastosowania jest wyzwaniem. Aby pomóc ci być na bieżąco z najnowszymi białkami fluorescencyjnymi, utrzymuję interaktywny wykres i tabelę najlepszych obecnie dostępnych białek fluorescencyjnych.
wybór zgodnych białek fluorescencyjnych
aby wybrać zestaw białek fluorescencyjnych do obrazowania razem, musisz wziąć pod uwagę te same czynniki, co przy wyborze pojedynczego białka fluorescencyjnego (jasność, fotostabilność itp.; Więcej informacji na temat tych czynników można znaleźć w poprzednim poście na blogu). Ponadto będziesz musiał wybrać fluorescencyjne białka, które można odróżnić od siebie i które można zobrazować za pomocą optyki na mikroskopie (- ach), którego zamierzasz używać. Dokładne określenie, czy dwa białka fluorescencyjne mogą być oddzielone od siebie, wymaga znajomości ich widma wzbudzenia i emisji, ale dobrą zasadą jest to, że zarówno szczytowe długości fal wzbudzenia, jak i szczytowa długość fali emisji dwóch białek powinny być oddzielone o 50-60 nm. Na przykład, CFP (ex 430 nm / em 474 nm) i YFP (ex 514 nm / em 527 nm) mogą być obrazowane razem, ale CFP i GFP (ex 488 nm / em 507 nm) wykazują pewne przesłuchy między dwoma białkami fluorescencyjnymi. Jeśli musisz zobrazować białka fluorescencyjne, których widma pokrywają się, istnieją techniki, takie jak unmiksowanie spektralne, które można wykorzystać do oddzielenia białek fluorescencyjnych, ale są one poza zakresem tego postu.
czy Twoje fluorescencyjne białka są kompatybilne z optyką mikroskopu?
aby określić, czy białka fluorescencyjne, które Cię interesują, są kompatybilne z optyką mikroskopu, będziesz chciał porównać widma wzbudzenia i emisji białka z zestawami filtrów lub laserami mikroskopu. Idealnie, chcielibyśmy mieć znaczne nakładanie się między filtrami wzbudzenia i emisji a widmami wzbudzenia i emisji białka, tak aby białko było dobrze wzbudzone przez mikroskop, a emisja fluorescencji białka jest skutecznie zbierana przez mikroskop. Aby porównać dopasowanie między białkiem fluorescencyjnym a zestawem filtrów, wielu dostawców zestawów filtrów zapewnia narzędzia do wykreślania widm fluorescencyjnych białek i barwników oraz ich filtrów (patrz Chroma, Semrock lub Omega). Chociaż nie zawierają one wszystkie fluorescencyjne białka w powszechnym użyciu (szczególnie nie te ostatnio opublikowane), mogą być dobrym punktem wyjścia. W wielu przypadkach wystarczy użyć spektrum dla blisko spokrewnionego białka, jeśli wiesz, że twoje białko będące przedmiotem zainteresowania ma podobne spektrum. Na przykład, oto zrzut ekranu z przeglądarki Chroma Spectra Viewer porównujący standardowy zestaw filtrów Cy3 lub Rhodamine (Chroma #49004) z widmami zarówno mCherry, jak i TagRFP.
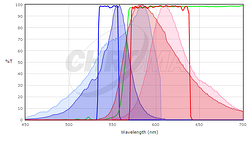
tutaj widmo TagRFP jest pokazane w ciemniejszych kolorach, a widmo mCherry jest pokazane w jaśniejszych kolorach; widma wzbudzenia są niebieskie, a widma emisji są czerwone. Nie jest to idealne dopasowanie do zestawu filtrów, ale filtr wzbudzenia wzbudza więcej piku wzbudzenia TagRFP, a filtr emisji zbiera większy ułamek emisji TagRFP niż emisja mCherry. Dla tego zestawu filtrów spodziewalibyśmy się, że TagRFP da jaśniejszy sygnał niż mCherry. Ogólnie rzecz biorąc, zestawy filtrów zaprojektowane dla Rodaminy / Cy3 będą działać lepiej z białkami fluorescencyjnymi o krótszej długości fali, takimi jak TagRFP lub mRuby2, niż z białkami o dłuższej długości fali, takimi jak mCherry. Aby uzyskać informacje na temat fluorescencji i zestawów filtrów, zobacz Wprowadzenie do mikroskopii fluorescencyjnej wykład w iBiology.
powszechnie stosowane zestawy filtrów& odpowiednie białka fluorescencyjne
powszechnie stosowane zestawy filtrów do obrazowania wielokolorowego obejmują zestawy zaprojektowane dla CFP, YFP i RFP lub zestaw czterech filtrów Sedat, zaprojektowany dla DAPI / fluoresceiny / Rodaminy / Cy5 (np. 405 / 488 / 561 / 640 nm). W naszych rękach najlepsze fluorescencyjne białka do obrazowania za pomocą tego zestawu to mTagBFP2, EGFP lub jeden z ulepszonych wariantów GFP, mRuby2 lub TagRFP-T oraz fluorescencyjne białko podczerwone, takie jak iFP1. 4 lub iFP2. 0. Uważaj, że te fluorescencyjne białka podczerwieni wymagają biliverdin jako kofaktora, więc może być konieczne uzupełnienie komórek biliverdin dla maksymalnej jasności. W komórkach ssaków jeden z ulepszonych wariantów fałdowania EGFP, takich jak mEmerald lub Koniczyna, jest prawdopodobnie najlepszy; mNeonGreen jest jeszcze nowszym zielonym białkiem fluorescencyjnym, które ma być niezwykle jasne. W S. cerevisiae, Przetestowaliśmy wiele zielonych i czerwonych białek fluorescencyjnych z tym zestawem filtrów i zgłosiliśmy pomiary jasności. Tutaj EGFP przewyższa ulepszone warianty składania, prawdopodobnie ze względu na niższą temperaturę wzrostu. Sugeruje to również, jednak, że nie ma jednego fluorescencyjnego białka optymalnego dla wszystkich organizmów i że jeśli chcesz najjaśniejszy sygnał, może być konieczne wypróbowanie kilku białek w systemie zainteresowania. Na koniec, w tym zestawie białek zielone i czerwone białka są na ogół najbardziej wykrywalne i dlatego powinny być używane do oznaczania najmniej obfitych białek, z niebieskimi i podczerwonymi kanałami używanymi do bardziej obfitych białek lub oznaczania przedziałów.
mam nadzieję, że rzuci to trochę światła na wielokolorowe obrazowanie za pomocą fluorescencyjnych białek. Przy odpowiednim mikroskopie i odpowiednim doborze fluorescencyjnych białek obrazowanie czterech kolorów jednocześnie powinno być dość proste.
Dziękujemy naszemu gościnnemu blogerowi!
 Kurt Thorn jest profesorem nadzwyczajnym na UCSF, gdzie kieruje Centrum obrazowania Nikon. Uzyskał doktorat z biofizyki na UCSF w laboratorium Ronalda Vale ’ a, po czym był stypendystą Bauer Center for Genomics Research na Uniwersytecie Harvarda. Dowiedz się więcej na jego stronie internetowej laboratorium lub blogu mikroskopii.
Kurt Thorn jest profesorem nadzwyczajnym na UCSF, gdzie kieruje Centrum obrazowania Nikon. Uzyskał doktorat z biofizyki na UCSF w laboratorium Ronalda Vale ’ a, po czym był stypendystą Bauer Center for Genomics Research na Uniwersytecie Harvarda. Dowiedz się więcej na jego stronie internetowej laboratorium lub blogu mikroskopii.