- plastyczność VSMCs w fizjologii i chorobie
- VSMCs wpływają na Adwentitię odpowiedzi immunologicznej u myszy Hiperlipidemicznych
- starzenie się czy przewlekłość czy jedno i drugie?
- nowo utworzone struktury Adwentitii uczestniczą w funkcji atlo poprzez promowanie recyrkulacji limfocytów
- formacja Atlo jest wysoce Terytorializowana, co wskazuje, że sygnały są przesyłane z płytek do Adwentii za pośrednictwem Organizatora tkanki limfatycznej VSMCs
- VSMCs bezpośrednio przyczyniają się do odporności Adwentii w miażdżycy
- wniosek
- wkład autora
- finansowanie
- Oświadczenie o konflikcie interesów
plastyczność VSMCs w fizjologii i chorobie
komórki mięśni gładkich naczyń (Vsmcs) są głównymi składnikami średnich i dużych tętnic. Chociaż mechanizmy miażdżycy w dużej mierze pozostają do zdefiniowania, badania wykazały, że progresja choroby obejmuje crosstalk między komórkami odpornościowymi z ECs i VSMCs. Niektóre z tych interakcji promują wzrost płytki nazębnej, podczas gdy inne zmniejszają rozmiar, skład komórkowy i stabilność blaszek miażdżycowych (1, 2) (Rysunek 1, Tabela 1). VSMCs wykazują niezwykłą plastyczność w odpowiedzi na uszkodzenia naczyń, stan zapalny i gromadzenie lipoprotein podczas progresji choroby poprzez przeprogramowanie ekspresji genu i przejście do proliferacyjnego, Pro-migracyjnego i aktywowanego fenotypu, tj. przełączanie fenotypu (5). Na rysunku 1 Przedstawiamy krytyczne przełączniki molekularne, które zostały zaproponowane jako ważne regulatory postępu choroby(3, 6, 8, 11). Podczas inicjacji miażdżycy, monocyty krwiopochodne, które zostały zrekrutowane do intymnej, gromadzą lipidy, nadając im pienisty wygląd. Komórki te przyczyniają się do powstawania smug tłuszczowych, które stanowią najwcześniejsze i ewentualnie odwracalne Stadium blaszek miażdżycowych. Smugi tłuszczowe stopniowo przekształcają się w miażdżyce/blaszki ostatecznie prowadzące do rozszerzonych blaszek zawierających VSMCs, komórki T i komórki mieloidalne (rycina 1) (33). Co ciekawe, skład płytki miażdżycowej, a nie jej rozmiar, określa jej stabilność, ponieważ włóknista Grubość pokrywy i martwicza wielkość rdzenia są potencjalnymi cechami charakterystycznymi stabilnej vs. niestabilnej płytki, odpowiednio (4, 9). Vsmc w warstwie intima są tradycyjnie postrzegane jako korzystne podczas miażdżycy, ponieważ wytwarzają składniki macierzy zewnątrzkomórkowej, promując w ten sposób tworzenie silniejszych włóknistych czapek, co skutkuje ochroną przed pęknięciem płytki nazębnej (4, 9). Jest coraz bardziej oczywiste, że Vsmc przechodzą mnóstwo strukturalnych i funkcjonalnych przekształceń fenotypowych, a nawet mogą całkowicie stracić swoje natywne cechy, aby uzyskać cechy innych typów komórek, w tym makrofagów. Dane wskazują, że Vsmc mogą nabywać fenotypy dychotomiczne o charakterze typu głowy Janusa, tj. właściwości pro-vs.przeciwmiażdżycowe, w zależności od środowiska tkankowego i działania czynników ryzyka (3). VSMCs uwalniają cytokiny w celu stymulowania sąsiednich ECs do ekspresji cząsteczek adhezyjnych i uwalniania cytokin i/lub zwiększenia chemotaksji monocytów / makrofagów do płytki nazębnej (3, 34, 35) (Tabela 1). Dane te wskazują, że nagromadzenie VSMCs w nasadce włóknistej lub intimie jest korzystne, podczas gdy ich utrata lub przejście do fenotypu zapalnego jest szkodliwe, oraz że równowaga między proliferacją/migracją VSMCs a śmiercią/starzeniem determinuje miażdżycę a stabilność płytki nazębnej (3). Różne dodatkowe aspekty biologii VSMC w zdrowiu i chorobie zostały niedawno objęte szeregiem doskonałych recenzji (https://academic.oup.com/cardiovascres/issue/114/4) i nie będą omawiane tutaj. Poniżej skupiamy zatem uwagę na roli adwentyzmu i potencjalnym wpływie VSMCs w formacji ATLO.

Rysunek 1. Fenotypy VSMCs podczas progresji miażdżycy ujawniają niezwykłą plastyczność. ECs i VSMCs w blaszkach miażdżycowych wykazują aktywowane fenotypy ( ➊ ) (3, 4). Niektóre z Vsmc pochodzą z mediów po rekrutacji do intima; inne Vsmc mogą pochodzić ze szpiku kostnego lub mogą pochodzić z komórek mieloidalnych znajdujących się w krążeniu (➋) (3). Ułamek VSMCs (➌) (3, 5). VSMCs wydzielają składniki macierzy pozakomórkowej; pluripotentny czynnik transkrypcyjny, tj. Klf4, może odgrywać główną rolę w procesie określanym jako przełączanie fenotypu ( ➍ ) (6 ,7). W próbach osłony płytki miażdżycowej przed śmiertelnym pęknięciem, Oct4 może kontrolować proces, który został określony jako remigracja, tworząc włóknistą czapkę (➎) (4, 8-10). Starzenie się i apoptoza powodują wytwarzanie dodatkowych cytokin zapalnych, które tworzą martwicze jądro, inicjując błędne koło o śmiertelnych skutkach klinicznych w późnych stadiach choroby ( ➏ ) (3 ,4, 11).
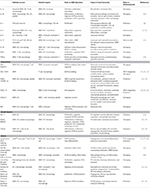
Tabela 1. Kluczowe mediatory zapalne biorące udział w odporności miażdżycy za pośrednictwem VSMC.
VSMCs wpływają na Adwentitię odpowiedzi immunologicznej u myszy Hiperlipidemicznych
w ciągu ostatnich dwóch dekad coraz bardziej stawało się oczywiste, że adwentitia jest wysoce złożoną i immunologicznie aktywną tkanką, w której znajdują się komórki tak różnorodne, jak komórki zrębowe, nerwy, naczynia limfatyczne, naczynia wazonowe i rezydujące leukocyty/komórki progenitorowe, z których wszystkie mają zdolność wpływania na postęp choroby (36, 37). Zaobserwowaliśmy, że adwentycja myszy ApoE−/− przechodzi poważne zdarzenia restrukturyzacyjne we wszystkich stadiach miażdżycy: Zarówno wrodzone, jak i adaptacyjne komórki odpornościowe gromadzą się w sąsiedztwie sąsiednich blaszek miażdżycowych (ryc. 2). Co więcej, nasze badania na myszach doświadczalnych potwierdziły się w tętnicach chorych na człowieka: my i inni obserwowaliśmy struktury podobne do ATLO w adwentii pacjentów z tętniakami miażdżycowymi aorty (38, 39), a ostatnio Akhavanpoor et al. obserwowany dobrze rozwinięty ATLOs u znacznego odsetka pacjentów cierpiących na chorobę niedokrwienną serca (40). W miażdżycy tętnic mysich, naczynia limfatyczne, żylaki śródbłonka (HEV) i neogeneza naczyń krwionośnych są głównymi cechami tego procesu restrukturyzacji (16, 41).
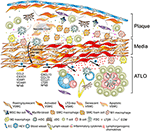
Rysunek 2. Komórki mięśni gładkich naczyń (vsmc) uczestniczą w odporności adwentitii podczas tworzenia płytki nazębnej. VSMCs umieszczonych między blaszkami miażdżycowymi a adwentią przyjmują fenotyp podobny do organizatora tkanki limfatycznej po aktywacji za pomocą sygnałów pochodzących z płytki nazębnej ( ➊ ), a następnie transdyferencjatu w komórki podobne do LTO ( ➋ ). Za pomocą fenotypu ekspresji proliferacyjnej i cytokin wpływają na restrukturyzację i rzeźbienie adwentyzmu, w tym angiogenezę, powstawanie HEV i neogenezę naczyń limfatycznych ( ➌ ). Zmiana fenotypu powoduje również ekspresję i wydzielanie chemokin limfogennych, tj. CXCL13 i CCL21, promując tym samym tworzenie ATLO przedstawione schematycznie w dolnej części grafu ( ➍ ).
starzenie się czy przewlekłość czy jedno i drugie?
co ważne, starzenie się okazało się głównym wyznacznikiem restrukturyzacji adwentyzmu i rzeźbienia. W pełni rozwinięta forma ATLOs w zaawansowanych stadiach miażdżycy, ale ich wczesne stadia, tj. Agregaty komórek T / B, pojawiają się równolegle do tworzenia blaszek miażdżycowych(16, 27, 41, 42). Rzeczywiście, te wczesne ATLOs tworzą się w wieku ~30 tygodni i osiągają bardziej zaawansowane stadium w około 52 tygodniu, aby osiągnąć szczyt w 78 tygodniu (16, 41). Podobne zależne od wieku stadia rozwojowe TLOs obserwowano w innych przewlekłych chorobach nierozwiązywalnych (1, 42). Dane te wskazują, że rozwój ATLO zależy od wieku, a starzenie się jest pozytywnie związane z rzeźbieniem adwentystycznym (ryc. 2). Jednak związek między starzeniem się i przewlekłość jest trudne do zbadania w miażdżycy miażdżycowej miażdżycy jak rozwój płytki miażdżycowej rozpoczyna się w łuku aorty, a następnie podróżuje zasiane aorty do osiągnięcia aorty brzusznej w późniejszych stadiach choroby w ten sposób przy dłuższych okresach czasu. Potrzeba więcej pracy, aby wyjaśnić ważną kwestię, czy starzenie się komórek odpornościowych i/lub VSMC przyczynia się do powstawania ATLO i jakie typy komórek, tj., VSMCs, ECs i/lub komórki odpornościowe są zaangażowane. Badania nad innymi formami powstawania TLO, takimi jak te występujące w płucach i przewodzie pokarmowym, wskazywałyby, że to właśnie przewlekłość trwałej reakcji zapalnej tkanek, a nie prawdziwe procesy starzenia się układu odpornościowego, ma decydujący wpływ na powstawanie ATLOs (43, 44).
nowo utworzone struktury Adwentitii uczestniczą w funkcji atlo poprzez promowanie recyrkulacji limfocytów
zaawansowane stadia ATLO obejmują Agregaty komórek T/B, Ośrodki germinalne w aktywowanych pęcherzykach limfatycznych B, naczynia limfatyczne, HEVs w obszarach komórek T i zewnątrzkomórkowe siatki przewodowe (16). Te główne zmiany przypominają struktury przypominające te Znalezione w drugorzędowych narządach limfatycznych, gdzie promują podstawowe aspekty odpowiedzi immunologicznej w kierunku antygenu, w tym recyrkulację naiwnych limfocytów w celu znalezienia ich antygenów poznawczych/autoantygenów, i organizowanie dojrzewania powinowactwa komórek B w kierunku potencjalnych autoantygenów. Stosując adoptywne badania transferu limfocytów, zaobserwowaliśmy, że ATLOs znacznie zwiększa rekrutację limfocytów do ściany tętniczej, zarówno poprzez promowanie imigracji, jak i równoczesne tłumienie emigracji niedoświadczonych limfocytów antygenowych (27). Po ich rekrutacji limfocyty T stają się aktywowane, zaczynają się namnażać, a niektóre limfocyty pomocnicze T CD4 są przekształcane w indukowane limfocyty regulatorowe T. Dane te ujawniają, że układ odpornościowy w adwentycji jest bardzo wrażliwy na podstawową reakcję zapalną tkanki ściany tętnicy. Co więcej, Komórki B, które tworzą centra germinalne w aktywowanych pęcherzykach limfocytów B, wydają się ulegać reakcji centrum germinalnego w obecności pęcherzykowych komórek dendrytycznych, gdzie niektóre są przekształcane w komórki B pamięci, podczas gdy inne opuszczają centra germinalne, aby stać się komórkami plazmatycznymi (45). Gdy zebrane razem, Dane te wskazują, że ATLOs zamiast drugorzędowych narządów limfatycznych (jak wcześniej sądzono) organizują odporność miażdżycy.
formacja Atlo jest wysoce Terytorializowana, co wskazuje, że sygnały są przesyłane z płytek do Adwentii za pośrednictwem Organizatora tkanki limfatycznej VSMCs
innym aspektem restrukturyzacji adwentii podczas miażdżycy jest to, że formacja ATLO jest wysoce terytorializowana i w dużej mierze ogranicza się do segmentów adwentii przylegających do blaszek miażdżycowych w aorcie brzusznej u myszy (16, 45). ATLOs są tylko sporadycznie znaleźć w adwentii tętnicy innominate lub łuku aorty, gdzie miażdżyca jest najbardziej widoczne. Komórki odpornościowe w segmentach piersiowych aorty składają się głównie z agregatów limfocytów T w porównaniu do ATLOs w aorcie brzusznej (16, 41). Dokładny mechanizm powstawania ATLOs w aorcie brzusznej jest nadal nieznany. Tlo wydają się być cechą wielu przewlekłych, nierozwiązywalnych chorób zapalnych i są znaczącymi cechami chorób autoimmunologicznych (42). Celularność i struktury tlo w miażdżycy są podobne do tlo w wielu innych chorób przewlekłych, w tym związanych z rakiem formacji tlo (46, 47). Dziedzina biologii TLO znacznie rozszerzyła się w ostatnich latach, podnosząc ważną możliwość, że nowy cel terapeutyczny może zostać zidentyfikowany poprzez zrozumienie funkcji tlo w każdej z chorób związanych z tlo. Jednak różne typy TLOs ujawniają pewne specyficzne cechy choroby, które mogą ostatecznie określić, czy związane z nimi odpowiedzi immunologiczne są szkodliwe lub ochronne. Takie specyficzne dla choroby cechy mogą wynikać z jednego z kilku mechanizmów, w tym swoistości narządów i charakteru uszkodzenia tkanek (1, 42). Rozwój narządów limfatycznych jest złożonym procesem, który obejmuje komórki krwiotwórcze tkanki limfatycznej (LTI), komórki nie-krwiotwórcze zrębowej tkanki limfatycznej (LTO) i sygnalizację LTßR. Nasze badania in vitro VSMCs aorty myszy wykazały, że po odpowiedniej stymulacji mogą one służyć jako komórki podobne do LTo( 20), pierwotnie zidentyfikowane podczas rozwoju embrionalnego podczas tworzenia wtórnych tkanek limfatycznych, w tym węzłów chłonnych i śledziony (48, 49) (patrz poniżej). Należy zauważyć, że ATLOs wydają się obejmować Vsmc jako ważnych uczestników, podczas gdy inne tlo obejmują inne komórki mezenchymalne podobne do LTo (50). Wspólnym mianownikiem wszystkich form TLOs wydaje się jednak–w przeciwieństwie do wtórnych narządów limfatycznych–przewlekła reakcja zapalna tkanki, która napędza układ odpornościowy do tworzenia tych struktur limfatycznych w pobliżu lub w niektórych przypadkach w obrębie chorej tkanki (42, 43).
VSMCs bezpośrednio przyczyniają się do odporności Adwentii w miażdżycy
ze względu na wysoce terytorialny charakter ATLOs przylegających do blaszek miażdżycowych, uznaliśmy, że VSMCs mogą być zaangażowane w powstawanie ATLO i tym samym mogą odgrywać rolę funkcjonalną w rozwoju miażdżycy. VSMCs silnie wyraża konstytutywnie LTßR (16), podczas gdy jego ligand LTa1ß2 ulega ekspresji na różnych komórkach układu odpornościowego zwanych komórkami LTi (51). Istnieje hipoteza, że VSMCs jest aktywowany przez szlak sygnałowy LTßR-LT przez komórki LTi biorące udział w wtórnej neogenezie tkanki limfatycznej. Pochodzenie komórek LTi nie zostało jeszcze jednoznacznie określone, chociaż aktywowane makrofagi i inne komórki odpornościowe w płytce wewnętrznej są kandydatami do tej aktywności w neogenezie LTO. W odpowiedzi na komórkowe i rozpuszczalne mediatory VSMCs wydają się ulegać odrębnemu typowi fenotypu, zmieniającemu się na fenotyp podobny do LTO przez wydzielanie parakryny przez chemokiny limfogenne, tj. CXCL13 i CCL21, przyciągając w ten sposób komórki odpornościowe, np. makrofagi/komórki dendrytyczne, komórki T i komórki B do lokalnego środowiska adwentii, co prowadzi do powstania ATLO w adwentii (27, 41, 45) (Tabela 1). Globalny lub specyficzny dla VSMC niedobór LTßR u starszych myszy APOE−/− hiperlipidemicznych wykazywał zwiększone tworzenie się płytki miażdżycowej, wskazując, że Vsmc LTßR ma zdolność do łagodzenia rozwoju miażdżycy w pewnych warunkach doświadczalnych (27). Inne badania wykazały jednak, że młode globalne myszy APOE−/− LTbR−/−utrzymywane w diecie wysokotłuszczowej (HFD) wykazały mniejsze obciążenie płytki aorty niż ich normalne odpowiedniki APOE-/− karmione dietą (52). Te pozornie sprzeczne dane wskazują, że role LTßR u młodych myszy i w warunkach nadmiernej hiperlipidemii mogą być różne w obu modelach. Alternatywnie, dieta wysokotłuszczowa, która prowadzi do dramatycznych i prawdopodobnie odurzających poziomów lipidów w osoczu, może być odpowiedzialna za te różnice. Ponieważ nie stosujemy regularnie diety wysokotłuszczowej u myszy ApoE−/−, rozbieżności te pozostają nierozwiązane, chociaż wykazano ,że układ odpornościowy może być przytłoczony ekstremalnymi poziomami lipidów w osoczu. Dane te wymagają dalszych badań w celu zbadania molekularnych podstaw pozornej dychotomii LTßR w progresji miażdżycy u młodych vs. starszych myszy i / lub wczesnych vs. zaawansowanych miażdżycy. Ponadto makrofagi Pochodzące ze szpiku kostnego mogą funkcjonować jako niezależne od LTßR komórki LTi i wyzwalać ekspresję CCL19, CCL20 i CXCL16 przez VSMCs (53) (Tabela 1). Tak więc, VSMCs może uczestniczyć w tworzeniu TLOs w miażdżycy przez upregulację limfogennych chemokin w celu promowania agregatów komórek odpornościowych w adwentii. Jak wspomniano powyżej, ATLOs są powszechne u ludzi obciążonych niedokrwienną chorobą wieńcową serca (40) i u ludzkich tętniaków miażdżycowych aorty (38, 39). W połączeniu, występowanie ATLOs u myszy doświadczalnych i u ludzi miażdżycy rodzi ważne pytania dotyczące natury miażdżycy jako choroby autoimmunologicznej: jest możliwe, że podczas miażdżycy powstają autoimmunologiczne komórki T i autoimmunologiczne komórki B skierowane przeciwko jeszcze nie zidentyfikowanym autoantygenom. Izolacja takich autoimmunologicznych limfocytów, w tym sekwencjonowanie ich receptorów limfocytów T i / lub receptorów limfocytów B, pozwoliłaby na przetestowanie głównych hipotez w miażdżycy. Rzeczywiście, badania nad miażdżycą uległyby znaczącej zmianie I możliwe stałoby się testowanie poszczególnych autoimmunologicznych klonów limfocytów w funkcjonalnych układach in vitro i In vivo.
wniosek
miażdżyca jest chorobą zapalną tętnic. VSMCs komunikują się zarówno z ECS i komórek odpornościowych w blaszkach miażdżycowych i komórek rezydujących w adwentii. Zdolność ta pozwala VSMCs wpływać na odporność miażdżycy w głównych sposobów, w tym tworzenie ATLOs. Dalsze prace są wymagane do określenia roli VSMCs w różnych stadiach miażdżycy, określić ich rolę w młodych vs. starzenie tętnic, i wyjaśnić dalsze ich dychotomiczne role w progresji choroby. Lepsze zrozumienie tych procesów może otworzyć drogę do opracowania strategii terapeutycznych dla przyszłej interwencji w klinicznie ważnych późnych stadiach choroby.
wkład autora
wszyscy autorzy przyczynili się do zaprojektowania, napisania i edycji nadesłanego manuskryptu i zatwierdzili go do publikacji.
finansowanie
Oświadczenie o konflikcie interesów
autorzy oświadczają, że badanie zostało przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
4. Clarke MC, Figg N, Maguire JJ, Davenport AP, Goddard M, Littlewood TD et al. Apoptoza komórek mięśni gładkich naczyń indukuje cechy podatności płytki nazębnej w miażdżycy. Nat Med. (2006) 12:1075–80. doi: 10.1038 / nm1459
PubMed Abstract / CrossRef Full Text / Google Scholar
5. Owens GK, Kumar MS, Wamhoff BR. Molekularna Regulacja różnicowania komórek mięśni gładkich naczyń w rozwoju i chorobach. Physiol Rev. (2004) 84: 767-801. doi: 10.1152 / physrev.00041.2003
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
6. Shankman LS, Gomez D, Cherepanova OA, Salmon M, Alencar GF, Haskins RM, et al. Zależna od KLF4 modulacja fenotypowa komórek mięśni gładkich odgrywa kluczową rolę w patogenezie płytki miażdżycowej. Nat Med. (2015) 21:628–37. doi: 10.1038 / nm.3866
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
7. Gomez D, Owens GK. Zmiana fenotypowa komórek mięśni gładkich w miażdżycy. Cardiovasc Res. (2012) 95: 156-64. doi: 10.1093/cvr / cvs115
PubMed Abstract / CrossRef Full Text / Google Scholar
8. Cherepanova OA, Gomez D, Shankman LS, Swiatlowska P, Williams J, Sarmento OF, et al. Aktywacja czynnika PLURIPOTENCJI OCT4 w komórkach mięśni gładkich jest miażdżycowa. Nat Med. (2016) 22:657–65. doi: 10.1038 / nm.4109
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
10. Yla-Herttuala S, Bentzon JF, Daemen M, Falk E, Garcia-Garcia HM, Herrmann J, et al. Stabilizacja blaszek miażdżycowych. Stanowisko Grupy Roboczej Europejskiego Towarzystwa Kardiologicznego (ESC)ds. miażdżycy i biologii naczyniowej. Thromb Hemost. (2011) 106:1–19. doi: 10.1160 / TH10-12-0784
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
11. Grootaert MOJ, Moulis M, Roth L, Martinet w, Vindis C, Bennett MR, et al. Śmierć komórek mięśni gładkich naczyń, autofagia i starzenie się w miażdżycy. (2018) 114:622-34. doi: 10.1093/cvr / cvy007
PubMed Abstract / CrossRef Full Text / Google Scholar
14. Akhavanpoor M, Akhavanpoor H, Gleissner CA, Wangler s, Doesch ao, Katus HA, et al. Dwie Twarze interleukiny-17A w miażdżycy. Cel Narkotykowy Curr. (2017) 18:863–73. doi: 10.2174/1389450117666161229142155
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
15. Jia G, Cheng G, Gangahar DM, Agrawal DK. Insulinopodobny czynnik wzrostu-1 i TNF-alfa regulują autofagię poprzez n-końcową kinazę C-jun i szlaki Akt w ludzkich gładkich komórkach naczyń miażdżycowych. Immunol Cell Biol. (2006) 84:448–54. doi: 10.1111 / j. 1440-1711. 2006. 01454.x
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
16. Grabner R, Lotzer K, Dopping S, Hildner m, Radke D, Beer M i in. Sygnalizacja receptora limfotoksyny beta Promuje trzeciorzędową organogenezę limfoidalną w aorcie adventitia starszych myszy ApoE -/ -. J Exp Med. (2009) 206:233–48. doi: 10.1084 / jem.20080752
CrossRef Pełny Tekst / Google Scholar
17. Damas JK, Smith C, Oie E, Fevang B, Halvorsen B, Waehre T, et al. Zwiększona ekspresja chemokin homeostatycznych CCL19 i CCL21 w miażdżycy klinicznej i Doświadczalnej: możliwa rola patogenna w destabilizacji płytki nazębnej. Arterioskler Thromb Vasc Biol. (2007) 27:614–20. doi: 10.1161/01.ATV.0000255581.38523.7c
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Doring Y, Noels H, van der Vorst EPC, Neideck C, Egea V, Drechsler M, et al. Vascular CXCR4 limits atherosclerosis by maintaining arterial integrity: evidence from mouse and human studies. Circulation. (2017) 136:388–403. doi: 10.1161/CIRCULATIONAHA.117.027646
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Akhtar S, Gremse F, Kiessling F, Weber C, Schober A. CXCL12 promotes the stabilization of atherosclerotic lesions mediated by smooth muscle progenitor cells in Apoe-deficient mice. Arterioscler Thromb Vasc Biol. (2013) 33:679–86. doi: 10.1161/ATVBAHA.112.301162
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Lotzer K, Dopping S, Connert S, Grabner R, Spanbroek R, Lemser B, et al. Mouse aorta smooth muscle cells differentiate into lymphoid tissue organizer-like cells on combined tumor necrosis factor receptor-1/lymphotoxin beta-receptor NF-kappaB signaling. Arterioscler Thromb Vasc Biol. (2010) 30:395–402. doi: 10.1161 / ATVBAHA.109.191395
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
21. Smedbakken LM, Halvorsen B, Daissormont I, Ranheim T, Michelsen AE, Skjelland m, et al. Podwyższony poziom homeostatycznej chemokiny cxcl13 w miażdżycy u ludzi-potencjalna rola w stabilizacji płytki nazębnej. Miażdżyca. (2012) 224:266–73. doi: 10.1016 / j. miażdżyca.2012.06.071
CrossRef Pełny Tekst / Google Scholar
22. Higashi Y, Sukhanov S, Shai Sy, Danchuk s, Tang R, Snarski P, et al. Niedobór receptora insulinopodobnego czynnika wzrostu-1 w makrofagach przyspiesza miażdżycę i indukuje niestabilny fenotyp płytki nazębnej u myszy z niedoborem apolipoproteiny E. Krążenie. (2016) 133:2263–78. doi: 10.1161 / circulation.116.021805
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
23. Alexander MR, Owens GK. Epigenetyczna Kontrola różnicowania komórek mięśni gładkich i przełączania fenotypowego w rozwoju naczyń i chorobach. Annu Rev Physiol. (2012) 74:13–40. doi: 10.1146 / annurev-physiol-012110-142315
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
24. He C, Medley SC, Hu T, Hinsdale ME, Lupu F, Virmani R, et al. Sygnalizacja PDGFRbeta reguluje miejscowe stany zapalne i synergizuje się z hipercholesterolemią w celu promowania miażdżycy. Nat Commun. (2015) 6:7770. doi: 10.1038 / ncomms8770
PubMed Abstract / CrossRef Full Text / Google Scholar
26. Da Ros F, Carnevale R, Cifelli G, Bizzotto D, Casaburo m, Perrotta m, et al. Kierowanie interleukiny-1beta chroni przed tętniakami aorty wywołanymi przez zakłóconą transformującą sygnalizację beta czynnika wzrostu. Immunitet. (2017) 47: 959-73 e9. doi: 10.1016 / j.2017.10.016
CrossRef Pełny Tekst / Google Scholar
27. Hu d, Mohanta SK, Yin C, Peng L, Ma z, Srikakulapu P, et al. Tętnicze trzeciorzędowe narządy limfatyczne kontrolują odporność aorty i chronią przed miażdżycą poprzez receptory limfotoksyn beta komórek mięśni gładkich naczyń krwionośnych. Immunitet. (2015) 42:1100–15. doi: 10.1016 / j.2015.05.015
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
29. Paramel Varghese G, Folkersen L, Strawbridge RJ, Halvorsen B, Yndestad a, Ranheim T, et al. NLRP3 inflammasome ekspresji i aktywacji w ludzkiej miażdżycy. Jestem Sercem Assoc. (2016) 5: e003031. 10.1161 / JAHA115.003031
CrossRef Pełny Tekst / Google Scholar
30. de Jong RJ, Paulin N, Lemnitzer P, Viola JR, Winter C, Ferraro B, et al. Zdolność ochronna aneksyny A1 w tworzeniu neointimy tętniczej u myszy podatnych na miażdżycę-krótki raport. Arterioskler Thromb Vasc Biol. (2017) 37:312–5. doi: 10.1161 / ATVBAHA.116.308744
CrossRef Pełny Tekst / Google Scholar
32. van Gils JM, Derby MC, Fernandes LR, Ramkhelawon B, Ray TD, Rayner KJ, et al. Neuroimmunologiczna wskazówka przewodnia netrin-1 sprzyja miażdżycy poprzez hamowanie emigracji makrofagów z blaszek. Nat Immunol. (2012) 13:136–43. doi: 10.1038 / ni.2205
CrossRef Pełny Tekst / Google Scholar
35. Tchkonia T, Zhu Y, van Deursen J, Campisi J, Kirkland JL. Starzenie komórkowe i fenotyp wydzielniczy starzenia: możliwości terapeutyczne. J Clin Invest. (2013) 123:966–72. doi: 10.1172 / JCI64098
PubMed Abstract / CrossRef Full Text / Google Scholar
37. Majesky MW, Horita H, Ostriker a, Lu S, Regan JN, Bagchi A, et al. Zróżnicowane komórki mięśni gładkich generują subpopulację rezydujących komórek progenitorowych naczyń w adwentii regulowanej przez Klf4. 120:296-311. doi: 10.1161 / CIRCRESAHA.116.309322
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
40. Akhavanpoor m, Gleissner CA, Akhavanpoor H, Lasitschka F, Doesch ao, Katus HA, et al. Adwential trzeciorzędowa klasyfikacja narządów limfatycznych w miażdżycy u ludzi. Pathol Cardiovasc. (2018) 32:8–14. doi: 10.1016 / j.carpath.2017.08.002
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
41. Moos MP, John N, Grabner R, Nossmann s, Gunther B, Vollandt R, et al. Lamina adventitia jest głównym miejscem gromadzenia się komórek odpornościowych u myszy z niedoborem apolipoproteiny e karmionych pokarmem pokarmowym. Arterioskler Thromb Vasc Biol. (2005) 25:2386–91. doi: 10.1161/01.ATV.0000187470.31662.fe
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
42. Mohanta SK, Yin C, Peng L, Srikakulapu P, Bontha V, Hu D, et al. Tętnicze trzeciorzędowe narządy limfatyczne przyczyniają się do wrodzonej i adaptacyjnej odpowiedzi immunologicznej w zaawansowanej miażdżycy myszy. (2014) 114:1772-87. doi: 10.1161 / CIRCRESAHA.114.301137
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
43. Buettner m, Lochner M. Rozwój i funkcja drugorzędowych i trzeciorzędowych narządów limfatycznych w jelicie cienkim i okrężnicy. Front Immunol. (2016) 7:342. doi: 10.3389 / fimmu.2016.00342
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
45. Srikakulapu P, Hu D, Yin C, Mohanta SK, BONTHA SV, Peng L, et al. Tętnicze trzeciorzędowe organy limfatyczne kontrolują wielowarstwowe, terytorialne reakcje miażdżycy limfocytów B u starszych myszy APOE. Arterioskler Thromb Vasc Biol. (2016) 36:1174–85. doi: 10.1161 / ATVBAHA.115.306983
CrossRef Pełny Tekst / Google Scholar
48. van de Pavert SA, Mebius RE. Nowe spojrzenie na rozwój tkanek limfatycznych. Nat Rev Immunol. (2010) 10:664–74. doi: 10.1038 / nri2832
CrossRef Full Text / Google Scholar
50. Barone F, Gardner DH, Nayar S, Steinthal N, Buckley CD, Luther SA. Fibroblasty zrębowe w trzeciorzędowych strukturach limfatycznych: nowy cel w przewlekłym zapaleniu. Front Immunol. (2016) 7:477. doi: 10.3389 / fimmu.2016.00477
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
51. Scandella E, Bolinger B, Lattmann e, Miller S, Favre s, Littman DR, et al. Przywrócenie integralności narządu limfatycznego poprzez interakcję komórek tkanki limfatycznej-induktora z zrębem strefy limfatycznej T. Nat Immunol. (2008) 9:667–75. doi: 10.1038 / ni.1605
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
52. Grandoch m, Feldmann K, Gothert JR, Dick LS, Homann S, Klatt C, et al. Deficiency in lymphotoxin beta receptor protects from atherosclerosis in apoE-deficient mice. Circ Res. (2015) 116:e57–68. doi: 10.1161/CIRCRESAHA.116.305723
PubMed Abstract | CrossRef Full Text | Google Scholar
53. Guedj K, Khallou-Laschet J, Clement M, Morvan M, Gaston AT, Fornasa G, et al. M1 macrophages act as LTbetaR-independent lymphoid tissue inducer cells during atherosclerosis-related lymphoid neogenesis. Cardiovascular research. (2014) 101:434–43. doi: 10.1093/cvr/cvt263
PubMed Abstract | CrossRef Full Text | Google Scholar