Tło
encefalopatia Hashimoto (HE) jest rzadkim zespołem Neuropsychiatrycznym związanym z przeciwciałami tarczycy i została po raz pierwszy zgłoszona przez mózg w 1996 roku (Brain et al., 1966). Przedstawia szeroki zakres objawów klinicznych, w tym objawy neurologiczne, takie jak epizody podobne do udaru, drgawki, splątanie, mioklonie, ataksja, drżenia i demencja, a także objawy psychiatryczne, w tym ostra psychoza, zaburzenia depresyjne, zmiany osobowości, halucynacje i schizofrenia (Kirshner, 2014; Menon et al., 2017). W tym przypadku opisujemy pacjenta z HE, którego objawy kliniczne i wyniki badań laboratoryjnych naśladowały wirusowe zapalenie mózgu.
opis przypadku
do szpitala trafił 59-letni mężczyzna z gorączką, bólem głowy i niewygodną mową, która objawiała się powolną i niejasną mową. Zaprzeczył niedawnych infekcji, takich jak grypa lub zapalenie żołądka i jelit, podróży i innych możliwych przyczyn, które mogą być odpowiedzialne za gorączkę, która osiągnęła szczyt w 39,5°C. poprzednia historia medyczna ujawniła dna moczanowa przez 20 lat, ale nie leki zostały przepisane. Jego badanie neurologiczne oraz tomografia komputerowa czaszki (CT) i rezonans magnetyczny (MRI) (ryc. Wyniki EEG wykazały drobne nieprawidłowości w falach (5-20 µv 14-20 Hz β) emitowanych z obu półkul. Rutyna krwi, białko C-reaktywne, witamina B12 w surowicy i kwas foliowy, a także inne twórcy autoimmunizacji zawierające przeciwciało przeciwjądrowe (ANA), przeciwciała cytoplazmatyczne przeciw neutrofilom (ANCA) i czynniki reumatoidalne były nijakie. Płyn mózgowo-rdzeniowy (CSF) wykazywał zwiększoną liczbę białych krwinek (WBC) (104 × 106/L, zakres odniesienia 0-8 × 10^6/l) i podwyższony poziom białka (1,68 g/l, zakres odniesienia 0,15–0,45 g/l). W surowicy i płynie mózgowo-rdzeniowym stwierdzono ujemny wynik posiewu, rozmazu oraz przeciwciała bakteryjne, grzybicze, wirusowe i przeciw prątkom gruźlicy. Zdiagnozowano u niego wirusowe zapalenie mózgu i leczono go lekami przeciwwirusowymi. Objawy ustąpiły w ciągu tygodnia i został wypisany ze szpitala. Pięć miesięcy później ponownie skierowano go do naszego szpitala z powodu gorączki 38,5°C i sporadycznego zamieszania w wyrokach. Wykonano kolejne nakłucie lędźwiowe; liczba WBC w płynie mózgowo-rdzeniowym wynosiła 39 × 10^6/L, a zawartość białka wynosiła 1,32 G/L. Wyniki MRI czaszki i badań laboratoryjnych były prawie prawidłowe, z wyjątkiem pogorszenia czynności tarczycy i zwiększenia stężenia przeciwciał anty-tarczycy w surowicy i płynie mózgowo-rdzeniowym (CSF). Początkowe wyniki były następujące: w surowicy stężenie hormonu stymulującego tarczycę (TSH) wynosiło 43,39 uIU/ml (zakres odniesienia (RR): 0,27–4,2 uIU/ml), stężenie wolnej trijodotyroniny (FT3) wynosiło 2,89 pmol/ml (RR: 3,1–6,8 pmol/ml), stężenie wolnej tyroksyny (FT4) wynosiło 7,18 pmol/ml (RR: 12,0–22,0 pmol stężenie trijodotyroniny (TT3) wynosiło 1,17 pmol/ml (RR: 1,3–3.1 pmol/ml), and total thyroxine (TT4) concentration was 44.26 pmol/ml (RR: 66–181 pmol/ml); the titer of anti-thyroglobulin autoantibodies (TgAb) was 1274 IU/ml (RR: < 115 IU/ml) and the titer of anti-thyroperoxidase autoantibodies (TPOAb) was 600 IU/ml (RR: < 35 IU/ml). In the CSF, ATA was positive (TPOAb 17.06 IU/ml, TgAb 16.02 IU/ml). Ultrasound imaging indicated diffuse lesions of the thyroid. Analiza przeciwciał anty-NMDAR, AMPA1, AMPA2, LGI1, CASPR2, GABA, GAD, anty-Hu, Yo, Ri, MAI, MA2, CV2, Amfifizyna, SOX-1, Tr, ZIC4 i GAD65 była ujemna zarówno w surowicy, jak i w płynie mózgowo-rdzeniowym. Ostatecznie u pacjenta zdiagnozowano HE, zapalenie tarczycy Hashimoto i niedoczynność tarczycy oraz przepisano metyloprednizolon i Euthyroks. Metyloprednizolon rozpoczęto od dawki 80 mg / dobę przez 1 tydzień i zmniejszono do 40 mg / dobę w ciągu 2 tygodni; następnie przepisano doustny prednizolon, który odstawiono od maciory w dawce 5 mg na tydzień, czyli doustny prednizolon stosowano łącznie przez 8 tygodni. Objawy ustąpiły po 3 dniach. Pacjent pozostawał zdrowy w okresie obserwacji trwającym 1 rok.
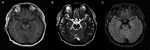
Rysunek 1. Obrazowanie MRI mózgu. Nie ma nieprawidłowych wyników w obrazowaniu MRI mózgu pacjenta. (A) obraz ważony T1; (B) obraz ważony T2; (C) obraz FLAIR.
dyskusja
szacowana częstość występowania HE wynosi 2,1 na 100 000, a stosunek płci (kobiet do mężczyzn) wynosi 4:1 (Ferracci i wsp., 2004). Przebieg może być progresywny, nawracająco-ustępujący, a nawet samoograniczający. W tym przypadku pacjent miał przebieg nawracająco-ustępujący.
w połączeniu z objawami pacjenta, prawidłowymi wynikami MRI, wysokimi mianami ATA w surowicy i pozytywnością ATA w płynie mózgowo-rdzeniowym, ostatecznie zdiagnozowano u pacjenta HE po wykluczeniu innych potencjalnych przyczyn, w tym udaru mózgu, guza, zakażenia ośrodkowego układu nerwowego, autoimmunologicznego zapalenia mózgu i zespołu paraneoplastycznego.
ogólnie patofizjologia jest nadal niejednoznaczna. Na podstawie wyników badań neuropatologicznych zaproponowano mechanizm autoimmunologicznego zapalenia naczyń. W poprzednim badaniu biopsje mózgu wykazały, że może być zaangażowany naciek limfocytarny wokół żyłek i tętniczek (Duffey i wsp ., 2003). Innym możliwym mechanizmem jest to, że atas atakują antygeny, które są wspólne dla tarczycy i mózgu, i z tego powodu wysokie miana atas, w tym tpoab, TgAb i przeciwciała przeciwko receptorowi TSH (TSH-R) w surowicy, a czasami w płynie mózgowo-rdzeniowym, są uważane za cechy charakterystyczne HE (Yoneda, 2018). Podobnie w naszym przypadku stwierdzono wysokie miana ATA i CSF-ATA. W poprzednim badaniu terapia wymiany osocza doprowadziła do głębokiej poprawy objawów u pacjentów (Tran i wsp ., 2018). Razem te ustalenia sugerują, że ATA odgrywa ważną rolę w HE. Jednakże podwyższone stężenie ATA w surowicy występuje również w populacji ogólnej i występuje szczególnie często u osób w podeszłym wieku. Ponadto stopień uniesienia ATA nie jest związany z nasileniem HE. Chociaż poziom ATA w surowicy pacjentów nadal pozostawał wysoki po leczeniu metyloprednizolonem, jego objawy ustąpiły (miano autoprzeciwciał przeciw tyreoglobulinie (tgab): 041 J. M./ml, RR: < 115 j. m./ml; miano autoprzeciwciał przeciw tyroperoksydazie (tpoa): 600 J. M./ ml, RR: <35 J. M./ml). Nasze wyniki potwierdzają, że nie ma związku między stopniem wzniesień ATA a nasileniem HE.
chociaż korelacja między ATA i HE jest nadal niejasna (Kirshner, 2014), kryteria diagnostyczne dla niego zostały zaproponowane przez zespół ekspertów w neurologii Lancet w 2016 roku. Kryteria są następujące: (1) encefalopatia z napadami padaczkowymi, miokloniami, omamami lub epizodami przypominającymi udar; (2)subkliniczna lub łagodna Jawna choroba tarczycy (zwykle niedoczynność tarczycy); (3) prawidłowe wyniki lub niespecyficzne nieprawidłowości wykazane przez MRI mózgu; (4) obecność przeciwciał tarczycy w surowicy (peroksydaza tarczycy, Tyreoglobulina); (5) Brak dobrze scharakteryzowanych przeciwciał neuronalnych w surowicy i płynie mózgowo-rdzeniowym; oraz (6) uzasadnione wykluczenie alternatywnych przyczyn. Można go zdiagnozować, jeśli pacjent spełnia wszystkie kryteria (Graus et al., 2016). Nasz pacjent spełnił wszystkie powyższe kryteria i dlatego można było go zdiagnozować. Większość pacjentów z on dobrze reaguje na sterydy; jednakże, gdy pacjenci są odporni na steroidy, inne terapie immunosupresyjne, w tym wymiana osocza, IVIg, metotreksat i mykofenolan, okazały się skuteczne. Najczęściej stosuje się wysokie dawki metyloprednizolonu (500-1000 mg). Ponieważ pacjent wykazywał łagodne objawy i odmowę stosowania wysokiej dawki metyloprednizolonu, przepisaliśmy niską dawkę metyloprednizolonu. Nasz pacjent przeszedł terapię steroidową i od tego czasu pozostaje zdrowy. W okresie obserwacji pacjent nie otrzymywał żadnych innych zabiegów immunoterapii. W retrospektywnym badaniu obserwacyjnym przeprowadzonym przez Mamoudjy i wsp. (2013) Wyniki badań wykazały, że niektórzy pacjenci HE przeszli nawrót, nawet trzeci atak, który miał krótszy czas przerwy (średnio 18 dni) w porównaniu z drugim atakiem (średnio 213 dni). Pacjenci z nawrotami potrzebowali ponownie metyloprednizolonu lub leczenia immunosupresyjnego (Mamoudjy i wsp., 2013). Nasz pacjent doznał jednego nawrotu około 150 dni po pierwszym ataku i terapia sterydowa była skuteczna. Następstwa, takie jak bóle głowy, zaburzenia pamięci i tak dalej, były również częste (Mamoudjy i wsp., 2013), jednak nasz pacjent nie miał na szczęście żadnych następstw.
encefalopatia Hashimoto jest trudna do dokładnego zdiagnozowania, ze względu na jej związek z szerokim zakresem objawów klinicznych, a także niespecyficzne neuroobrazowanie i elektroencefalogram. W poprzednim artykule opisano przypadek HE, który początkowo został błędnie zdiagnozowany jako wirusowe zapalenie mózgu (He i wsp., 2013), w którym pacjent wykazywał stopniowe upośledzenie funkcji poznawczych i niekontrolowane napady bez gorączki. W naszym przypadku zwiększona liczba WBC i białko CSF w połączeniu z gorączką i bólem głowy prowadzą do zdiagnozowania go jako wirusowego zapalenia mózgu. Gorączka została opisana u kilku pacjentów z HE z zaburzeniami tarczycy i bez nich (Huang i wsp ., 2011; Lu et al., 2015). Chociaż przyczyna gorączki w On jest niejasna, Lu et al. (2015) zasugerował, że może to być bezpośredni wynik zapalenia w połączeniu z autoimmunologicznym zapaleniem naczyń.
encefalopatia Hashimoto może objawiać się na wiele różnych sposobów, w tym epizody podobne do udaru mózgu, drgawki, splątanie, mioklonie, ostra psychoza, zaburzenia depresyjne i halucynacje, powodując, że jest mylony z innymi chorobami. Uwatoko i in. (2018) poinformował o przypadku pacjenta, który przedstawił z parkinsonizmem i zmianą podobną do guza ujawnioną przez MRI mózgu. Po biopsji stwierdzono, że zmiana nie była nowotworem, i ostatecznie potwierdzono (Uwatoko et al., 2018). Pacjenci z HE mogą również występować z nietypowymi objawami, takimi jak porażenie pseudobulbarowe, polineuropatia czuciowo-motoryczna, objawy katatoniczne, zawroty głowy, osłabienie mięśni, pląsawica, opsoklonie i ból głowy typu nerwu trójdzielnego (Beckmann et al., 2011; Salazar et al., 2012; Sharan et al., 2015; Ueno et al., 2016; Karthik et al., 2017; Emeksiz et al., 2018; Oz Tuncer et al., 2018). Szybko postępująca demencja, jako powszechna manifestacja HE, sprawia, że konieczne jest odróżnienie go od innych chorób spowodowanych czynnikami naczyniowymi, zakaźnymi, toksyczno-metabolicznymi i autoimmunologicznymi, przerzutami/nowotworami, jatrogennymi/wrodzonymi błędami metabolizmu, chorobami neurodegeneracyjnymi i chorobami układowymi/napadami (Paterson et al., 2012).
wnioski
podsumowując, diagnoza HE jest dość złożona, ale cenna ze względu na dramatyczną odpowiedź na leczenie immunosupresyjne. W przypadku wystąpienia niewyjaśnionego zapalenia mózgu czynność tarczycy i poziom ATA należy traktować jako konwencjonalne badania. Można go wykluczyć jako diagnozę u pacjentów z prawidłowym stężeniem ATA w surowicy. W przypadku pacjentów ze zwiększonym poziomem ATA należy go rozważyć po wykluczeniu innych możliwych chorób.
Oświadczenie o dostępności danych
zbiory danych wygenerowane dla tego badania są dostępne na żądanie do odpowiedniego autora.
Deklaracja Etyki
badania z udziałem ludzi zostały zweryfikowane i zatwierdzone przez Komisję Etyki pierwszego szpitala uniwersytetu Jilin w Chinach. Pacjenci / uczestnicy przedstawili pisemną świadomą zgodę na udział w tym badaniu. Pisemna, świadoma zgoda została uzyskana od osoby(osób) na publikację wszelkich potencjalnie możliwych do zidentyfikowania zdjęć lub danych zawartych w tym artykule.
wkład autora
HM przyczynił się do koncepcji i projektu rękopisu. Mój napisał pierwszy szkic rękopisu. YY, XM, YX i NS napisał fragmenty rękopisu. Wszyscy autorzy przyczynili się do rewizji manuskryptu, przeczytali i zaakceptowali nadesłaną wersję.
finansowanie
ta praca była wspierana przez Krajowy kluczowy program R& D Chin (nr 2017yfc0110304).
konflikt interesów
autorzy oświadczają, że badania zostały przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Beckmann, Y. Y., Top, D., and Yigit, T. (2011). Niezwykłe prezentacje encefalopatii Hashimoto: neuralgiaform ból głowy, odchylenie krzywizny, hipomania. Endocrine 40, 495-496. doi: 10.1007 / s12020-011-9506-x
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Brain, L., Jellinek, E. H., and Ball, K. (1966). Choroba Hashimoto i encefalopatia. Lancet 2, 512-514.
Google Scholar
Duffey, P., Yee, S., Reid, I. N., and Bridges, L. R. (2003). Encefalopatia Hashimoto: wyniki pośmiertne po zgonie w stanie padaczkowym. Neurology 61, 1124-1126.
PubMed Abstrakt / Google Scholar
Emeksiz, S., Kutlu, N. O., Alacakir, N., and Caksen, H. (2018). Przypadek encefalopatii Hashimoto opornej na steroidy, charakteryzującej się polineuropatią sensorimotorową. Turk. J. Pediatr. 60, 310–314. doi: 10.24953 / turkjped.2018.03.012
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Ferracci, F., Bertiato, G., and Moretto, G. (2004). Encefalopatia Hashimoto: dane epidemiologiczne i rozważania patogenetyczne. J. Neurol. Sci. 217, 165–168.
PubMed Abstrakt / Google Scholar
Graus, F., Titulaer, M. J., Balu, R., Benseler, S., Bien, C. G., Cellucci, T., et al. (2016). Kliniczne podejście do diagnostyki autoimmunologicznego zapalenia mózgu. Lancet Neurol. 15, 391–404.
Google Scholar
He, L., Li, M., Long, X. H., Li, X. P., and Peng, Y. (2013). Przypadek encefalopatii Hashimoto błędnie zdiagnozowanej jako wirusowe zapalenie mózgu. Am. J. Case Rep. 14, 366-369.
Google Scholar
Huang, W., Xia, C., and Chatham, M. (2011). Choroba zakaźna lub encefalopatia Hashimoto: opis przypadku. Zajęcie 20, 717-719. doi: 10.1016 / j.2011.04.011
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Karthik, M. S., Nandhini, K., Subashini, V., and Balakrishnan, R. (2017). Encefalopatia Hashimoto przedstawia nietypowe zaburzenia zachowania u dorastającej dziewczyny. Sprawa Rep.Med. 2017, 3494310. doi: 10.1155/2017/3494310
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
Kirshner, H. S. (2014). Encefalopatia Hashimoto: krótka recenzja. Curr. Neurol. Neurosci. 14:476.
Google Scholar
Lu, T., Zhou, Z., Wu, A., Qin, B., and Lu, Z. (2015). Gorączkowa encefalopatia Hashimoto związana z Hashitoxicosis. Acta Neurol. Belg. 115, 811–813.
Google Scholar
Mamoudjy, N., Korff, C., Maurey, H., Blanchard, G., Steshenko, D., Loiseau-Corvez, M. N., et al. (2013). Encefalopatia Hashimoto: identyfikacja i długoterminowe wyniki u dzieci. Eur. J. Pediatr. Neurol. 17, 280–287. doi: 10.1016 / j.ejpn.2012.11.003
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Menon, V., Subramanian, K., and Thamizh, J. S. (2017). Psychiatryczne prezentacje zwiastujące encefalopatię Hashimoto: systematyczny przegląd i analiza przypadków opisywanych w literaturze. J. Neurosci. Wiejski. Pract. 8, 261–267. doi: 10.4103 / jnrp.jnrp_440_16
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Oz Tuncer, G., Teber, S., Kutluk, M. G., Albayrak, P., and Deda, G. (2018). Encefalopatia Hashimoto prezentująca się jako porażenie pseudobulbarowe. Childs Nerv. Syst. 34, 1251–1254. doi: 10.1007 / s00381-018-3720-2
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
Paterson, R. W., Takada, L. T., and Geschwind, M. D. (2012). Diagnostyka i leczenie szybko postępujących demencji. Neurol Clin. Pract. 2, 187–200.
PubMed Abstrakt / Google Scholar
Salazar, R., Mehta, C., Zaher, N., and Miller, D. (2012). Opsoklonus jako przejaw encefalopatii Hashimoto. J. Clin. Neurosci. 19, 1465–1466. doi: 10.1016 / j.jocn.2012.02.012
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Sharan, A., Sengupta, S., Mukhopadhyay, S., and Ghosh, B. (2015). Encefalopatia Hashimoto z pląsawicą. J. Assoc. Physicians India 63, 83-84.
PubMed Abstrakt / Google Scholar
Tran, M. H., Mkhikian, H., Sy, M., Perez-Alvarez, I., and Demetriou, M. (2018). Długotrwała wymiana osocza jako leczenie podtrzymujące encefalopatii Hashimoto typu móżdżkowego, opis przypadku. Transfuzję. Apher. Sci. 57, 418–420. doi: 10.1016 / j.transci.2018.05.027
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Ueno, H., Nishizato, C., Shimazu, T., Watanabe, H., Mizukami, T., Kosuge, H., et al. (2016). Encefalopatia Hashimoto wykazująca zawroty głowy i osłabienie mięśni u męskiego pacjenta pediatrycznego. Nr Hattatsu 48, 45-47.
PubMed Abstrakt / Google Scholar
Uwatoko, H., Yabe, I., Sato, S., Abe, M., Shirai, S., Takahashi, I., et al. (2018). Encefalopatia Hashimoto naśladująca guza mózgu i jego patologiczne odkrycia: opis przypadku. J. Neurol. Sci. 394, 141–143. doi: 10.1016 / j.jns.2018.09.008
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
Yoneda, M. (2018). Encefalopatia i autoprzeciwciała Hashimoto. Nerw Mózgowy 70, 305-314. doi: 10.11477 / mf.1416201004
PubMed Abstrakt / CrossRef Pełny Tekst / Google Scholar