Inferior petrosal sinus sampling (IPSS) jest inwazyjną procedurą, w której poziomy hormonu adrenokortykotropowego (ACTH) są pobierane z żył, które drenują przysadkę mózgową; poziomy te są następnie porównywane z poziomami ACTH we krwi obwodowej, aby określić, czy guz przysadki (w przeciwieństwie do ektopowego źródła ACTH) jest odpowiedzialny za zależny od ACTH zespół Cushinga. IPSS może być również stosowany do ustalenia, po której stronie przysadki mózgowej znajduje się guz.
choroba Cushinga wynika z nadmiernej produkcji kortyzolu z powodu podwyższonego poziomu ACTH wytwarzanego przez guz przysadki mózgowej. W przeciwieństwie do tego, zespół Cushinga obejmuje wszystkie warunki hiperkortyzolizmu z powodu przyczyn zależnych od ACTH (np. choroba Cushinga lub pozamaciczne wydzielanie ACTH przez nowotwór niezwiązany z przysadką mózgową) lub przyczyn niezależnych od ACTH (np. nadmierne autonomiczne wydzielanie kortyzolu z nadczynnego guza kory nadnerczy).
inne i rzadsze stany, które mogą prowadzić do zespołu Cushinga, obejmują ektopowe wydzielanie hormonu uwalniającego kortykotropinę (CRH), pierwotny obustronny pigmentowany guzkowy rozrost nadnerczy, makrorodowy rozrost nadnerczy, pozamaciczne działanie peptydów hamujących żołądek i inne zespoły, takie jak zespół McCune-Albrighta i zespół Carneya. Stany Pseudo-Cushinga o podobnych objawach klinicznych można znaleźć w depresji i uzależnieniu od alkoholu. Cechy cushingoidów można również znaleźć w otyłości.
różnicowanie choroby Cushinga zależnej od ACTH od choroby Cushinga niezależnej od ACTH jest często proste, ale może być trudne do odróżnienia choroby Cushinga od hiperkortyzolizmu spowodowanego ektopowym wydzielaniem ACTH (tj. od źródła pozapitowego) ze względu na cykliczne i przerywane wydzielanie przez guzy wydzielające ACTH oraz różne wrażliwości i specyficzności różnych testów biochemicznych. Według Prabhu et al (2002) wartość obrazowania przekrojowego w zależnym od ACTH zespole Cushinga jest również ograniczona, ponieważ małe niefunkcjonujące przysadki są obecne w do 10% skanów MRI wykonanych u zdrowych młodych ludzi.
słaba czułość obrazowania na mikroadenomy przysadki to kolejny problem. Gruczolaki przysadki wydzielające ACTH są trudne do zidentyfikowania w standardowym rezonansie magnetycznym 1,5 T lub 3T, a także w obrazowaniu kontrastowym dynamicznym. W większości przypadków rutynowe badanie MRI z kontrastem thin slice wzmocnione T1 jest w stanie dostarczyć szczegółów anatomicznych i pomóc zidentyfikować wzór drenażu IPS. W niektórych przypadkach, gdy nie można zidentyfikować wzoru drenażu, nawet rozdzielczość przestrzenna nie pomaga w przedstawieniu złożonej anatomii. W takiej sytuacji sam IPSS pomaga odróżnić chorobę Cushinga od zespołu Cushinga z powodu ektopowych guzów wydzielających ACTH i dlatego nadal jest złotym standardem w diagnostyce gruczolaków przysadki wydzielających ACTH. Powszechnie wiadomo, że IPSS może dokładnie diagnozować chorobę Cushinga i wiadomo również, że MRI zapewnia większą dokładność w lokalizacji miejsca gruczolaka. Kakade i in. sugerują, że w przypadku niejednoznacznych wyników MRI przysadki mózgowej, wcześniejsze IPSS mogą uniknąć niepotrzebnych operacji transspenoidalnych. Jedno z badań donosi, że 7T MRI może pomóc w wykryciu standardowej choroby Cushinga 1,5 T i 3T MRI-ujemnej i może w przyszłości zapobiegać IPSS.
Historia pobierania próbek zatok petrosalnych
IPSS został wprowadzony w 1977 roku przez Corrigana i wsp., którzy zgłaszali zastosowanie jednostronnego selektywnego cewnikowania i pobierania próbek żylnych w celu zlokalizowania wydzielania ACTH u pacjenta z kłopotliwym obrazem klinicznym i laboratoryjnym zgodnym z ektopowym wydzielaniem ACTH lub zależnym od przysadki zespołem Cushinga. Później ustalono, że poziomy ACTH w żylnym drenażu przysadki mózgowej mogą być asymetryczne, ze względu na lokalizację gruczolaka kortykotropowego lub asymetryczne zmiany w anatomii żylnej.
drenaż żylny przysadki jest zwykle ipsilateralny, więc drenaż żylny po przeciwnej stronie w stosunku do gruczolaka często nie ma wysokiego stężenia ACTH. Doppman i wsp. (1984) sugerowali jednoczesne pobieranie próbek z obu dolnych zatok petrosalowych (IPSs) w celu uniknięcia fałszywie ujemnych wyników w obecności gruczolaka kortykotropowego przysadki mózgowej. Procedura ta była określana jako obustronne pobieranie próbek dna zatoki petrosalnej (BIPSS).
wiele gruczolaków kortykotropowych jest podatnych na stymulację przez egzogenne podawanie CRH, co zostało po raz pierwszy opisane w 1991 roku przez Oldfielda i wsp. w celu zwiększenia czułości BIPSS. W różnych badaniach stosowano dwie różne formy CRH: owczy CRH (oCRH) i ludzki CRH (hCRH). Nieman i wsp. (1989) donoszą, że obwodowe reakcje ACTH i kortyzolu na oCRH były znacznie wyższe niż w przypadku ludzkiego CRH.
przyszłość i kontrowersje
niektóre ośrodki odnotowały poprawę dokładności i lokalizacji wewnątrzgałkowej przy pobieraniu obustronnych próbek zatok jamistych, ale istnieje zwiększone ryzyko porażenia nerwu czaszkowego, więc ta technika nie zyskała jeszcze popularności.
próbkowanie żylnej żyły szyjnej wewnętrznej (Ijvs) również próbowano jako technicznie łatwiejszą alternatywę dla BIPSS. Radvany i in. porównano IJVS z IPSS u 30 kolejnych pacjentów z zależnym od ACTH zespołem Cushinga z ujemnym wynikiem MRI. Ich wyniki wskazują, że IJVS nie jest tak pomocny jak IPSS w diagnozowaniu przysadki jako źródła nadmiernego ACTH. Chociaż ijvs ma swoistość podobną do BIPSS, ma niższą czułość (83% w porównaniu do 94%), zgodnie z Ilias et al.
wykorzystując próbki pobrane z IPSS, Oklu i wsp. zidentyfikowali 3 małe potencjalne biomarkery choroby Cushinga (pirydoksat, kwas deoksycholowy i adypinian trimetylu). Mogą one wyjaśnić biologię nowotworu i sugerować, w przyszłości, możliwe diagnostyczne sondy obrazowania molekularnego i cele terapeutyczne u pacjentów z nawracającymi chorobami po operacji.
Anatomia właściwa
szczegółowy opis anatomii IPS dostarczyli Miller and Doppman (1991) (patrz zdjęcie poniżej).
 Anatomia dolnej Zatoki Petrosalnej
Anatomia dolnej Zatoki Petrosalnej u większości osób IPS zwęża się, aby stać się pojedynczą żyłą, opróżniając się do żyły szyjnej wewnętrznej ipsilateralnej (IJV). U około 25% osobników drenaż IPS tworzy splot kanałów, które opróżniają się do IJV. W 0,6%-7% osób nie ma związku między IJV i IPS, co uniemożliwia standardowe pobieranie próbek.
u około 60% osób drenaż żylny przysadki jest symetryczny, przy czym większość odpływu żylnego z każdej strony przysadki odprowadza się do ipsilateralnego IPS. W rezultacie u większości ludzi BIPSS może być skutecznym narzędziem do lateralizacji gruczolaków kortykotropowych i uniknięcia fałszywie ujemnych wyników.
Doppman et al (1999) przypisał 0.8% rozpowszechnienie fałszywie ujemnych wyników hipoplastycznych lub anomalnych IPS. Shiu i wsp. (1968) po raz pierwszy opisali system klasyfikacji wariantów anatomicznych IPS. Bonelli et al (2000) opisali modyfikację systemu klasyfikacji Shiu et al, w następujący sposób:
-
typ I (patrz rysunek poniżej): zespolenie IPS z IJV; przednia żyła kłykciowa jest nieobecna lub łączy się z IPS w określonym miejscu pochodzenia; krótki odcinek żyły od punktu zespolenia do IJV nazywany jest konduktorem dolnym
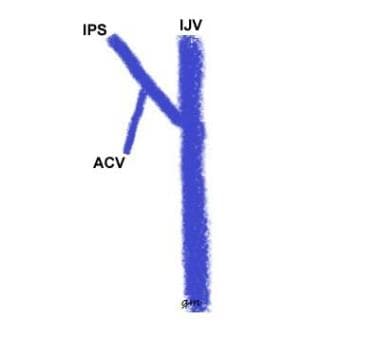 IPS variant type 1
IPS variant type 1 -
Typ II (patrz rysunek poniżej): wspólne pochodzenie IPS i przedniej żyły kłykciowej z IJV
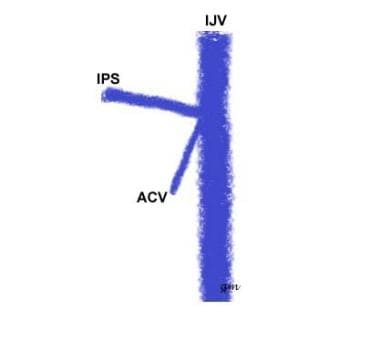 IPS variant type 2
IPS variant type 2 -
Typ III (patrz rysunek poniżej): IPS składający się z kilku małych kanałów komunikujących się z IJV
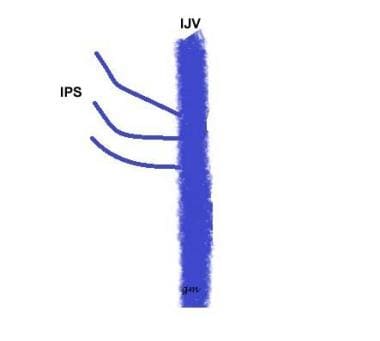 IPS Variant type 3
IPS Variant type 3 -
Typ IV (patrz rysunek poniżej): IPS, który komunikuje się z przednią żyłą kłykciową, a nie IJV
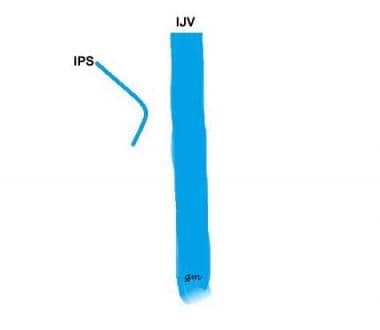 IPS variant type 4
IPS variant type 4
 IPS variant type 1
IPS variant type 1  IPS variant type 2
IPS variant type 2  IPS Variant type 3
IPS Variant type 3  IPS variant type 4
IPS variant type 4