Październik 26, 2020, przez personel NCI
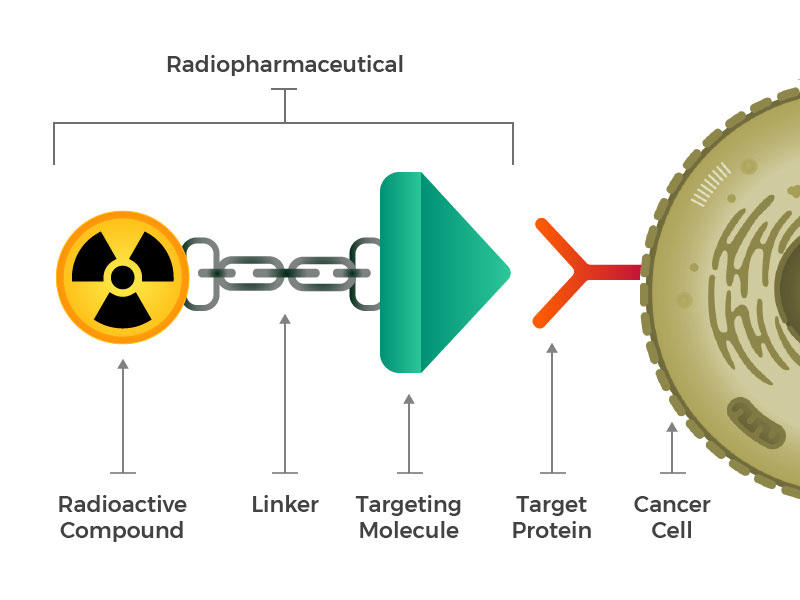
Radiofarmaceutyki składają się z cząsteczki radioaktywnej, cząsteczki celującej i łącznika, który łączy te dwa.
ostatnie dwie dekady przyniosły ogromną zmianę w sposobie leczenia wielu rodzajów raka. Terapie celowane zamykają specyficzne białka w komórkach nowotworowych, które pomagają im rosnąć, dzielić się i rozprzestrzeniać. Immunoterapia stymuluje lub hamuje układ odpornościowy organizmu, aby pomóc w walce z rakiem. Ale długo stosowane zabiegi-chirurgia, chemioterapia i radioterapia-pozostają podstawą leczenia większości nowotworów.
radioterapia została po raz pierwszy zastosowana w leczeniu raka ponad 100 lat temu. Około połowa wszystkich pacjentów z chorobą nowotworową nadal otrzymuje go w pewnym momencie podczas leczenia. Do niedawna większość radioterapii podawano tak samo jak 100 lat temu, dostarczając wiązki promieniowania z zewnątrz ciała, aby zabić guzy wewnątrz ciała.
chociaż skuteczne, promieniowanie zewnętrzne może również powodować szkody uboczne. Nawet z nowoczesnym sprzętem do radioterapii, „trzeba normalnej tkanki, aby dostać się do guza,” powiedział Charles Kunos, MD, Ph. D., z programu oceny terapii nowotworowej NCI (CTEP). Wynikające skutki uboczne radioterapii zależą od obszaru leczonego ciała, ale mogą obejmować utratę smaku, zmiany skórne, wypadanie włosów, biegunkę i problemy seksualne.
teraz naukowcy opracowują nową klasę leków zwanych radiofarmaceutykami, które dostarczają radioterapię bezpośrednio i konkretnie do komórek nowotworowych. W ciągu ostatnich kilku lat nastąpił wybuch badań i badań klinicznych testujących nowe radiofarmaceutyki.
badania te sugerują, że ukierunkowanie radioterapii na poziomie komórkowym może zmniejszyć ryzyko zarówno krótko -, jak i długoterminowych skutków ubocznych leczenia, jednocześnie umożliwiając zabijanie nawet niewielkich złogów komórek nowotworowych w całym ciele.
„myślę, że zmienią onkologię radiacyjną w ciągu najbliższych 10-15 lat” – powiedział dr Kunos.
opierając się na naturalnym powinowactwie
dostarczanie promieniowania bezpośrednio do komórek nie jest nowym podejściem. Jedna z takich terapii, zwana radioaktywnym jodem, była stosowana w leczeniu niektórych rodzajów raka tarczycy od 1940 roku. JOD naturalnie gromadzi się w komórkach tarczycy. W laboratorium można wytworzyć radioaktywną wersję pierwiastka. Po spożyciu (jako pigułka lub płyn) gromadzi się i zabija komórki nowotworowe pozostałe po operacji tarczycy.
podobne naturalne powinowactwo zostało później wykorzystane do opracowania leków do leczenia raka, który rozprzestrzenił się na kości, takich jak dichlorek Radu 223 (Xofigo), który został zatwierdzony w 2013 r.do leczenia przerzutowego raka prostaty. Kiedy komórki nowotworowe rosną w kościach, powodują one tkanki kostne, które atakują, aby rozbić. Ciało następnie próbuje naprawić to uszkodzenie poprzez zastąpienie tej Kości-proces zwany obrotem kostnym.
pierwiastek promieniotwórczy rad „wygląda jak cząsteczka wapnia, więc zostaje włączony do obszarów ciała, w których obrót kostny jest najwyższy”, takich jak obszary, w których rośnie rak, wyjaśnił dr Kunos. Rad jest wtedy w stanie zabić pobliskie komórki nowotworowe.
wszystkie te radioaktywne związki podróżują do komórek nowotworowych bez żadnej pomocy. Naukowcy zastanawiali się, czy możliwe byłoby zaprojektowanie nowych cząsteczek radioaktywnych, które konkretnie celują w inne nowotwory.
przewidywali oni skonstruowane radiofarmaceutyki, które składają się z trzech głównych elementów: cząsteczki radioaktywnej, cząsteczki celującej (która rozpoznaje i blokuje konkretnie komórki nowotworowe) oraz łącznika, który łączy te dwa elementy. Takie związki mogą być wstrzykiwane, podawane w infuzji, wdychane lub spożywane, a następnie przedostać się do krwiobiegu.
pomysł połączenia cząsteczki ukierunkowanej na raka z cząsteczką, która zabija komórki nowotworowe, również nie jest nowy. Na przykład kilka leków zwanych koniugatami przeciwciało-lek, w których przeciwciało, które wiąże się z określonymi komórkami nowotworowymi, jest związane z toksycznym lekiem, zostało zatwierdzonych do leczenia raka.
ale starania o stworzenie takich leków spotkały się z ograniczonym sukcesem, wyjaśnił dr Kunos, ponieważ nie wystarczy, aby toksyny były zbliżone do komórki nowotworowej. Toksyny muszą być pobierane do środka i pozostawać wewnątrz komórek wystarczająco długo, aby spowodować uszkodzenie. Wiele komórek nowotworowych ma lub rozwija mechanizmy, aby po prostu wypompować toksyny z powrotem, zanim to się stanie.
Radiofarmaceutyki działają również najlepiej, gdy leki mogą dostać się do komórek. Ale to nie jest konieczne, aby były skuteczne. Gdy radiofarmaceutyk przyklei się do komórki nowotworowej, radioaktywny związek ulega naturalnemu rozkładowi. Rozpad ten uwalnia energię, która uszkadza DNA pobliskich komórek. A kiedy DNA komórki jest nieodwracalnie uszkodzone, ta komórka umiera. Komórki nowotworowe są szczególnie wrażliwe na uszkodzenia DNA wywołane promieniowaniem.
W zależności od rodzaju zastosowanego związku radioaktywnego, otrzymana energia może przeniknąć do komórki związanej z radiofarmaceutykiem, a także około 10 do 30 komórek otaczających tę komórkę. Zwiększa to liczbę komórek nowotworowych, które można zabić za pomocą pojedynczej cząsteczki radiofarmaceutycznej.
W połowie 2010 roku Food and Drug Administration (FDA) zatwierdziła dwa radiofarmaceutyki, które celują w cząsteczki niektórych komórek B w leczeniu niektórych osób z chłoniakiem nieziarniczym, rodzajem raka krwi. Ale te leki Nigdy nie zostały powszechnie przyjęte. Niewielu lekarzy leczonych pacjentów z chłoniakiem zostało przeszkolonych do podawania tego typu związków radioaktywnych. A radiofarmaceutyki zmierzyły się z konkurencją ze strony nowszych, nieradioaktywnych leków.
przełom w tej dziedzinie nastąpił w 2018 r., powiedział dr Jacek Capala z Programu Badań nad promieniowaniem NCI, kiedy FDA zatwierdziła lutet Lu 177-dotatate (Lutathera) do leczenia niektórych nowotworowych guzów neuroendokrynnych (sieci) wpływających na przewód pokarmowy.
„to pokazało, że guzy lite mogą być również ukierunkowane w ten sposób”, z radiofarmaceutykiem zbudowanym od podstaw. W tym przypadku celem są pewne receptory hormonalne znajdujące się w obfitości na powierzchni komórek netto.
lutet Lu 177-dotatate był lepszy w spowolnieniu wzrostu netto niż jakikolwiek poprzedni testowany lek, wyjaśnił Aman Chauhan, MD, z University of Kentucky, który prowadzi kilka nowych badań klinicznych leku. „To był ogromny krok naprzód dla naszego pola”
adaptacja leków ze związków obrazowania
naukowcy projektują i testują radiofarmaceutyki w zakresie różnych nowotworów, takich jak czerniak, rak płuc, rak jelita grubego i białaczka, powiedział dr Capala. Każdy guz, który ma docelową cząsteczkę na powierzchni swoich komórek i dobry dopływ krwi-wystarczający do dostarczenia leków-może być potencjalnie leczony radiofarmaceutykami, dodaje dr Chauhan.
wiele z tych nowszych leków to zmodyfikowane wersje istniejących związków używanych do obrazowania jądrowego. Testy obrazowania jądrowego, takie jak pozytonowa tomografia emisyjna (PET), czasami używają słabo radioaktywnych związków związanych z cząsteczkami, które wiążą się z określonymi celami na powierzchni komórek nowotworowych. Wyspecjalizowane kamery mogą następnie ujawnić nawet niewielkie złogi komórek nowotworowych, pomagając zmierzyć rozprzestrzenianie się raka w organizmie.
naukowcy przestawili te cząsteczki docelowe, aby przenosiły silniejsze związki radioaktywne lub izotopy-te, które mogłyby zabijać komórki nowotworowe, zamiast po prostu pomagać w ich wizualizacji.
rak prostaty był wczesnym poligonem doświadczalnym dla tej zmiany przeznaczenia. Białko zwane PSMA znajduje się w dużych ilościach-i prawie wyłącznie-na komórkach prostaty. Łącząc cząsteczkę, która wiąże się z PSMA z radioaktywnym związkiem stosowanym w obrazowaniu PET, naukowcy byli w stanie wizualizować niewielkie złogi raka prostaty, które są zbyt małe, aby można je było wykryć za pomocą konwencjonalnego obrazowania.
kilka leków radiofarmaceutycznych ukierunkowanych na PSMA jest obecnie testowanych w badaniach klinicznych.
większość nowotworów prostaty jest bardzo wrażliwa na promieniowanie, a promieniowanie zewnętrzne jest powszechnie stosowane w leczeniu choroby, wyjaśnia Frank Lin, MD, z Centrum Badań nad Rakiem NCI, który prowadzi badanie kliniczne jednego radiofarmaceutyku skierowanego na PSMA w Centrum Klinicznym NIH.
większość mężczyzn, którzy otrzymują promieniowanie w początkowej fazie leczenia, nie doświadczy nawrotu raka. Ale jeśli tak, to czasami rozprzestrzenia się po całym ciele, z wieloma małymi złogami komórek nowotworowych w wielu narządach, wyjaśnił.
„kiedy guz rozprzestrzenił się w ten sposób, nie można już tak naprawdę wykonywać promieniowania zewnętrznego, ponieważ promieniowanie zewnętrzne może być skupione i leczyć tylko niewielką część ciała na raz”, powiedział dr Lin.
posiadanie radiofarmaceutyku, który jest skierowany na PSMA, jest lepszym sposobem na podanie promieniowania w tych przypadkach, ponieważ może być podawany bezpośrednio do krwiobiegu i krąży szeroko, przyłączając się do komórek raka prostaty, które rozprzestrzeniły się po całym ciele, wyjaśnił.
a dużą zaletą obrazowania i leczenia cząsteczek, które używają tego samego celu, jest to, że obrazowanie może dać lekarzom podgląd, czy leczenie może działać, dodał dr Lin.
na przykład w badaniu dr Lin mężczyźni muszą mieć tomografię PET z wersją obrazową związku przed leczeniem. Jeśli związek obrazujący trafi do komórek nowotworowych i zostanie wykryty na skanie PET, naukowcy mogą założyć, że odpowiednie leczenie radiofarmaceutyczne trafi do celu.
„ten komplementarny rozwój diagnostyki w parze z terapiami lekowymi sprawia, że ta dziedzina jest o wiele bardziej ekscytująca”, powiedział dr Chauhan. „W ten sposób możemy wiedzieć, że dostarczamy terapię bezpośrednio do komórek nowotworowych.”
przejście na terapie skojarzone
chociaż radiofarmaceutyki okazały się obiecujące we wczesnych badaniach, są również, podobnie jak w przypadku innych rodzajów leków przeciwnowotworowych, mało prawdopodobne, aby same wytępiły guza.
na przykład lutet Lu 177-dotatate ponad dwukrotnie zwiększył liczbę osób, u których guzy neuroendokrynne kurczyły się po leczeniu, ale liczba ta była nadal skromna: około 17%, w górę z 7% bez leku, wyjaśnił dr Chauhan.
stosowanie radiofarmaceutyków w połączeniu z innymi terapiami może być jednym ze sposobów osiągnięcia tej poprawy. Niektórzy badacze testują obecnie radiofarmaceutyki połączone z substancjami uczulającymi na promieniowanie—lekami, które sprawiają, że komórki nowotworowe są jeszcze bardziej podatne na promieniowanie. Na przykład, dr Chauhan prowadzi badanie kliniczne lutetu Lu 177-dotatate w połączeniu ze środkiem uczulającym na promieniowanie zwanym triapiną, który blokuje komórkom wytwarzanie związków potrzebnych do naprawy DNA po uszkodzeniach wywołanych promieniowaniem.
W innym badaniu dr Lin testuje lutet Lu 177-dotatate z rodzajem leku zwanego inhibitorem PARP. Leki te, które są już zatwierdzone do leczenia niektórych typów nowotworów piersi, jajników i innych, blokują proces naprawy DNA. „Więc promieniowanie spowodowałoby uszkodzenie DNA, a inhibitor PARP uniemożliwiłby komórkom nowotworowym wyleczenie ich DNA po napromieniowaniu” – wyjaśnił.
inni badacze łączą radiofarmaceutyki z immunoterapią, aby spróbować zwiększyć skuteczność tych leków. „Ostatnie badania wykazały, że radiofarmaceutyki mogą uczynić nowotwory bardziej wrażliwymi na immunoterapię”, powiedział dr Capala.
wiele guzów jest guzami „zimnymi”, wyjaśnił, że komórki odpornościowe ich nie rozpoznają lub nie działają prawidłowo w mikrośrodowisku wokół guzów, wyjaśnił.
ale kiedy promieniowanie zabija komórki nowotworowe, białka i DNA z tych komórek mogą rozlać się do krwiobiegu, aby komórki odpornościowe mogły zobaczyć, co może pozwolić komórkom odpornościowym rozpoznać i zabić inne komórki nowotworowe w całym ciele. Radioterapia może również zrobić mikrośrodowiska nowotworu bardziej gościnni komórek odpornościowych, dodał dr Capala.
łącznie te efekty mogą przekształcić zimnego guza w” gorącego ” guza: takiego, który ma mnóstwo komórek odpornościowych i może reagować na leki immunoterapeutyczne. Niektóre badania próbowały użyć promieniowania zewnętrznego do stworzenia tego rodzaju reakcji.
„ale są dane sugerujące, że działa lepiej, jeśli każdy guz, każdy przerzut, jest narażony na promieniowanie. Tak więc terapia radiofarmaceutyczna ma tam swoją zaletę, że gdy trafi do organizmu, dociera do wszystkich przerzutów”, wyjaśnia dr Capala.
może nawet sensowne jest łączenie radiofarmaceutyków z promieniowaniem zewnętrznym, o ile staranne planowanie leczenia może zapewnić bezpieczną całkowitą dawkę promieniowania, dodaje dr Capala. „Radioterapia zewnętrzna jest bardzo dobra w leczeniu dużych guzów, a następnie można ją połączyć z terapią radiofarmaceutyczną w celu ukierunkowania przerzutów” – powiedział.
wyzwania i przestrogi
dziedzina radiofarmaceutyków jest jeszcze w swoich początkach. Jednym z wyzwań, które trzeba będzie przezwyciężyć, zanim będzie można je szerzej wykorzystać, jest niedobór lekarzy przeszkolonych do podawania takich leków.
„liczba lekarzy medycyny nuklearnej w USA jest niewielka”, powiedział dr Lin, który ma szkolenie zarówno w medycynie nuklearnej, jak i Onkologii Medycznej. „I myślę, że szkolimy tylko może 70 lub 80 nowych ludzi rocznie.”
do tej pory ten niedobór siły roboczej uniemożliwił wykorzystanie prawdziwego potencjału radiofarmaceutyków jako spersonalizowanego leczenia, wyjaśnia dr Capala. Potencjał ten odzwierciedla fakt, że w przeciwieństwie do innych rodzajów leków przeciwnowotworowych, lekarze mogą używać obrazowania, aby dokładnie zmierzyć, ile radiofarmaceutyków osiągnęło guz, prawie w czasie rzeczywistym, i odpowiednio dostosować dawkę.
ale ten rodzaj planowania leczenia wymaga wielodyscyplinarnej wiedzy, która nie jest powszechnie dostępna i sprawiła, że ludzie używali radiofarmaceutyków bardziej jako „chemioterapii radioaktywnej”, z jedną uniwersalną dawką, dodał. „Oznacza to, że wielu pacjentów nie otrzymuje optymalnego leczenia”, powiedział dr Capala.
potrzebne są również długoterminowe badania bezpieczeństwa, dodał dr Chauhan. Osoby leczone radioterapią zewnętrzną mogą wystąpić pewne skutki uboczne, zwane późnymi skutkami – takimi jak rozwój drugiego nowotworu-miesiące lub lata po leczeniu. Chociaż dotychczasowe badania nie wykazały wysokiego wskaźnika późnych efektów leczenia radiofarmaceutycznego, „są to bardzo nowe środki i musimy nadal być ostrożni i monitorować je” – powiedział.
ponieważ leki te są stosunkowo nowe, nawet przy trwających badaniach, „po prostu drapiemy powierzchnię opracowywania leków dla radiofarmaceutyków” – powiedział dr Chauhan.
w 2019 r., aby jeszcze bardziej przyspieszyć badania obiecujących nowych radiofarmaceutyków, NCI uruchomiła inicjatywę rozwoju radiofarmaceutycznego (RDI), aby przyspieszyć obiecujące nowe leki w testach klinicznych.
jedną z rzeczy, które NCI ma nadzieję osiągnąć dzięki RDI, jest pośrednictwo w większej liczbie badań przy użyciu kombinacji leków produkowanych przez różne firmy farmaceutyczne, które mogą nie współpracować w inny sposób, wyjaśnia dr Kunos, który prowadzi inicjatywę. Obawy dotyczące własności intelektualnej i brak zaufania mogą powstrzymać takie projekty przed ich rozpoczęciem, wyjaśnia dr Kunos.
„tego typu współpraca niekoniecznie musiałaby się odbyć, gdyby NCI nie był uczciwym pośrednikiem w środku” Obecnie tylko około 2% badań we wczesnej fazie wspieranych przez NCI testuje radiofarmaceutyki, ale dzięki RDI może to gwałtownie wzrosnąć w nadchodzących latach-dodał.
„nie wyeliminujemy maszyn ani innych technik, których używamy w radioterapii”, powiedział dr Kunos. „Ale z ich ukierunkowaną naturą uważamy, że radiofarmaceutyki zmienią sposób, w jaki wykorzystujemy promieniowanie.”