Rysunek 4: Budowa oka.To zdjęcie pochodzi z Chirstie (ref. 4) i jest zastrzeżona prawem autorskim według podanego źródła (tzn. nie jest to praca własna autorów).
struktura oka: obszar wewnątrz oka (patrz rysunek 4), który wykrywa światło i kolor, jest nazywany siatkówką. Dwa rodzaje obecnych komórek detekcyjnych, pręty i stożki, przetwarzają informacje przechodzące przez soczewkę i wysyłają je przez nerw wzrokowy do mózgu. Komórki prętowe (których jest około 100 milionów) wykrywają stopień lekkości wchodzącej do oka, a ich czułość zależy od ilości obecnej rodopsyny, która sama jest wytwarzana w komórkach. Jednakże Rodopsyna ulega zniszczeniu w wyniku ekspozycji na światło i dlatego komórki prętów działają tylko w słabym świetle, ponieważ przy dużym oświetleniu obniżony poziom tego światłoczułego pigmentu prowadzi do bardzo niskiej czułości. Komórki stożkowe (których jest około 3 milionów) są również wrażliwe na poziom światła, ale zachowują swoją funkcję do wysokiego oświetlenia dzięki zastosowaniu Jodopsyny pigmentowej.Wykrywanie koloru jest funkcją trzech rodzajów komórek stożkowych obecnych w siatkówce: między nimi pokrywają widmo widzialne. Dzieje się tak dlatego, że każdy typ jest wrażliwy na inny zakres długości fal z maksymalnąodpowiedzialny na czerwony (długi), zielony (średni) lub niebieski (krótki).
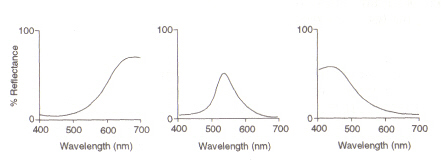
ryc. 5: maksimum (od) odpowiednio czerwonych, zielonych i niebieskich komórek stożka. To zdjęcie pochodzi z Chirstie (ref. 4) i jest zastrzeżona prawem autorskim według podanego źródła (tzn. nie jest to dzieło własne autorów).
mechanizm rodopsyny w komórkach rodopsyny: białko rodopsyny zawiera protonowany kompleks zasadowyretinal-Schiffa, który naturalnie znajduje się w kieszeni międzybłonowej utworzonej przez siedem transbłonowych helicalreceptorów a -. Istnieje wiele płaskich dysków rodopsyny w zewnętrznym segmencie komórki arod, które po wykryciu światła ulegają fotoizomerycznej zmianie Z rodopsyny (11-cis) do all-trans siatkówki. Po kaskadzie fotoizomeryzacji, która zachodzi przez 5 krótkożyciowych intermediatów (schemat przepływu 1), trans siatkówka dyfunduje i jest przekształcana z powrotem w 11-cisretinal przed ponownym wejściem do cyklu. Proces ten zachodzi poprzez redukcję do retinolu all-trans, a następnie utlenianie / izomeryzację w ciemności. Fotoeksycytedrhodopsyna (4 z 5 półproduktów) uruchamia enzymatyczny proces kaskadowy w hydrolizie GMP. To z kolei zamyka kanały specyficzne dla kationów w błonie komórkowej pręta, które są naturalnie otwarte na napływ Na+w ciemności, a dzięki efektowi hiperpolaryzacji wewnętrzne ciało synatyczne wysyła sygnał nerwowy do innych neuronów w siatkówce. W końcu indukowany światłem poziom wapnia pomaga odzyskać pobudzone neurony do pasywnego, „ciemnego” stanu i cykl rozpoczyna się ponownie po wykryciu światła. Tefotoreceptory komórek stożka są również siedem helicalreceptory z 11-cis-siatkówki jako ich chromofor. Zakres detekcji różni się od zielonego do Czerwonego, ponieważ trzy niepolarne pozostałości zawierające hydroksyl w pobliżu retinalu są kolejno zastępowane polarnymi.

po lewej-Rysunek 6: Pozycja siatkówki 11-cis w obrębie rodopsyny. To zdjęcie pochodzi ze strony Stryera (ref. 6) i jest zastrzeżona prawem autorskim według podanego źródła (tzn. nie jest to dzieło własne autorów).
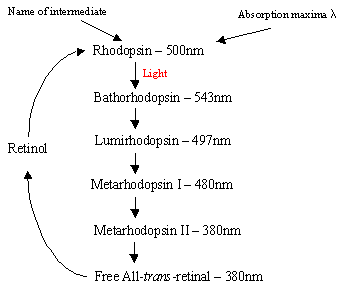
Right-Flowchart1: 5 półproduktów cyklu rodopsyny.
skąd pochodzi Rodopsyna?
ludzie nie mogą wytwarzać jodopsyny, zamiast tego używają i zewnętrznego źródła, b-karotenu, który znajduje się w żywności w celu jej syntezy:
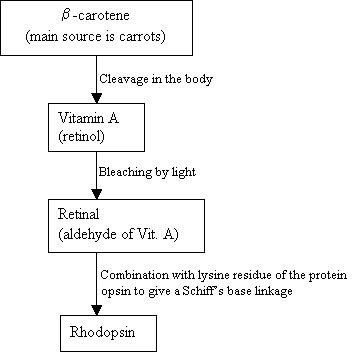 |
SCHEMAT BLOKOWY 2: Tezynteza rodopsyny nowe zdjęcie =rysunek 7: struktury b-karotenu (Góra), vitaminy (środek) i siatkówki 11-cis (dół). |
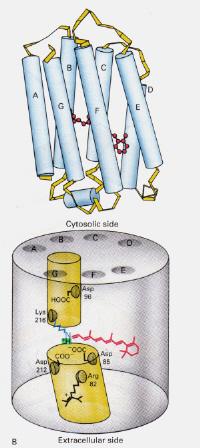
jak mechanizm bakteriohodopsyny występujący w Halobakteriach różni się od mechanizmu rodopsyny występującego w komórkach rod ludzkiego oka?: Tym razem protonowany zespół siatkówki-basecomplex Schiffa w naturalny sposób blokuje kanał przez membranę utworzoną w inny sposób przez dwie znajdujące się w niej Komory. Protonowany kompleks trans przekazuje proton Asp-85, który umożliwia wyjście tego samego protonu na stronę pozakomórkową. Fotoizomeryzacja do struktury 13-cis pozwala bazie Schiffa wybrać proton upa z reszty Asp-96 po stronie cytozolicznej. Po reorientacji formy cis na trans, cykl izomeryzacji i pompowania protonowego jest kontynuowany.