Kalmodulina
Oto wideo Wprowadzenie do białka sygnalizacji wapnia, kalmoduliny, z perspektywy chemika nieorganicznego!
Kalmodulina lub CaM jest polipeptydem wszechobecnym we wszystkich komórkach eukariotycznych. Białko to jest znane jako kalmodulina, ponieważ jest to białko modulowane wapniem, które odgrywa istotną rolę w procesie transdukcji sygnału wapniowego. Transdukcja sygnału wapniowego jest procesem, w którym interakcje między jonami wapnia i licznymi białkami pośredniczą w komunikacji między komórkami. funkcja kalmoduliny jest zatem niezbędna we wszystkich komórkach eukariotycznych, a niektóre z zadań, które pomaga wykonać, to sygnalizacja nerwowa, ruch mięśni szkieletowych i pamięć. Wykrywając jony wapnia w środowisku, kalmodulina aktywuje się, a następnie działa jako półprodukt, inicjując Wiązanie ważnych białek, takich jak kinazy, wspomagając nasze komórki w podstawowej i wyrafinowanej funkcji („Calmodulina”).
poniższy film pokazuje zmiany strukturalne zachodzące w CaM podczas wiązania wapnia (kody PDB 3CLN i 1CFD).
samo białko ma długość 148 aminokwasów z dwoma regionami kulistymi zawierającymi po 2 Motywy EF każdy, które są charakterystycznymi miejscami polipeptydów mediowanych wapniem. Po aktywacji kalmodulina zawiera 4 jony Ca2+, które drastycznie zmieniają kształt białka. Kiedy kalmodulina wiąże się z jonami wapnia, białko otwiera się od formy apo do formy halo, odsłaniając helisę alfa, która jest znana jako łącznik lub region centralnego wiązania. Ukuty ze względu na swoją elastyczność, środkowy region wiązania jest lokalizacją białka, na którym białka partnerskie wiążą się i przyczyniają się do kaskady, która jest wtórnym przekazem wapnia. Opierając się na swojej strukturze i potrzebie funkcjonowania jonów wapnia, kalmodulina musi być w stanie wybierać jony wapnia w cytoplazmie, a interakcje między Jonem a ligandami w domenach dłoni EF wspierają tę ideę selektywności (Bertini et. al., 635-638).
Ten obraz jest przedstawieniem tego, jak motyw EF-hand przypomina dłoń. Diagram wstęgi po lewej stronie przedstawia jeden z czterech charakterystycznych motywów dłoni Helix-turn-helix kalmoduliny. (Kod PDB 3CLN)
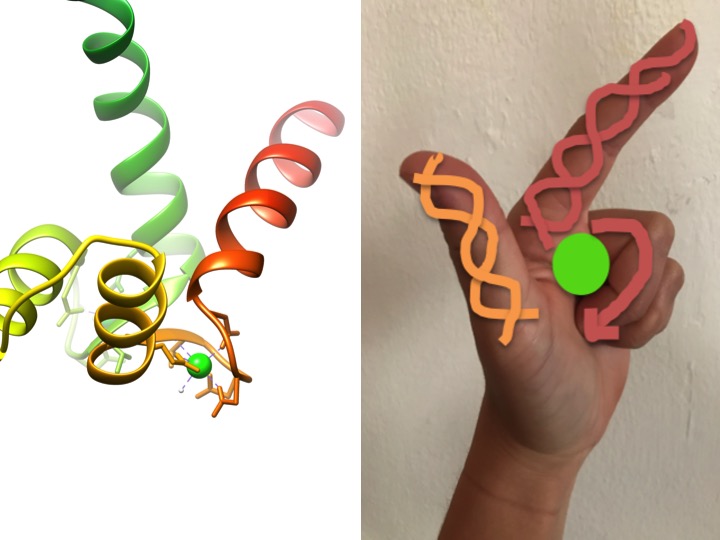
motywy EF-hand są silnie konserwowanymi regionami strukturalnymi białek biorącymi udział w wiązaniu wapnia. Obszary te są znane jako motywy „ręczne”, ponieważ przypominają rękę wykonaną w kształcie litery L, w której jon metalu znajduje się na środku pięści, spirale alfa są wskazywane przez palec wskazujący skierowany do góry i kciuk zwrócony do wewnątrz, a zwinięte palce reprezentują obszar zakrętu lub pętli. Jest to pokazane na rysunku powyżej. W charakterystycznym motywie EF-hand aminokwasy, w tym glutaminiany, asparaginy, kwasy asparaginowe i kwasy glutaminowe, wiążą się z Ca, a także z wodą (Bertini et. al. 639). Typową sekwencję wiązania domeny EF-hand przedstawiono na rysunku poniżej.
ten rysunek ilustruje skoordynowane aminokwasy w typowej domenie EF (dokładny skład aminokwasów jest różny!). Linia przerywana reprezentuje koordynację Ca z tlenem karbonylu szkieletu, podczas gdy linie stałe wskazują koordynację z łańcuchami bocznymi lub wodą.
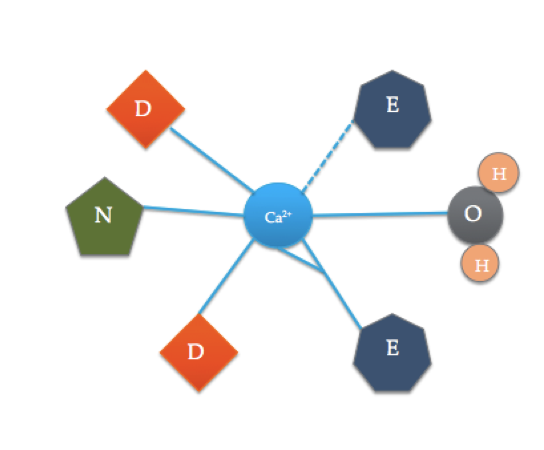
miejsce wiązania kalmoduliny jest nieco inne niż najbardziej typowa domena EF hand pokazana powyżej. 6 ligandów kalmoduliny obejmuje łańcuchy boczne trzech kwasów asparaginowych (D), 1 kwas glutaminowy (E), który tworzy dwa koordynujące wiązania kowalencyjne z Jonem, 1 cząsteczkę wody z roztworu i 1 cząsteczkę karbonylu ze szkieletu. Miejsce wiązania kalmoduliny składa się z jonu Ca2+ otoczonego 6 ligandami podczas tworzenia 7 wiązań.
można zauważyć, że motyw EF w obrębie calmoduliny zawiera wiele tych samych ligandów, tylko w różnych miejscach. Ta konformacja może dać wyobrażenie o tym, dlaczego kalmodulina jest selektywna dla wapnia i jak tylko obecność jonu wapnia może zaspokoić miejsce wiązania, które powoduje aktywację białka. Jest to związane z termodynamiką kalmoduliny w komórce i jej reakcją na obecność jonów wapnia.
aby zrozumieć termodynamikę łączącą aktywację kalmoduliny, należy najpierw zrozumieć stężenie jonów takich jak wapń i magnez w komórce eukariotycznej, w tym w komórce ludzkiej. Stężenie tych jonów musi być ściśle regulowane. Wewnątrz komórki sygnalizacji wapnia towarzyszy chwilowy wzrost stężenia jonów wapnia, który jest wykrywany przez białka takie jak kalmodulina (Bertini et. al., 636). Ten wzrost wapnia może być spowodowany wewnątrzkomórkowymi białkami G, które indukują szorstkie i gładkie retikulum do uwalniania wapnia, lub jony wapnia mogą być sprowadzane z przestrzeni zewnątrzkomórkowej. W przypadku kalmoduliny zwykle reaguje ona na doprowadzenie wapnia do komórki z zewnątrz, co zachodzi podczas procesów takich jak sygnalizacja nerwowa (Bertini et. al. 637). Zanim stężenie wapnia zostanie chwilowo podniesione, stężenie w komórce zwykle wynosi 10-100 nm, podczas gdy podczas krótkiego napływu jonów stężenie wzrasta do 1000-100 000 nm. Zmiana stężenia powoduje, że kalmodulina wyczuwa jony wapnia, wiąże je i inicjuje dalszą transdukcję sygnału (Bertini et. al., 635).
Jak zatem calmodulina definitywnie wiąże jony wapnia, a nie np. jony magnezu? Jony Mg2+ są w rzeczywistości bardzo podobne do jonów wapnia: będą one angażować się w oddziaływania elektrostatyczne, a nie kowalencyjne, i są uważane za twarde Atomy. Powód, dla którego kalmodulina wydaje się faworyzować jony wapnia, a nie jony magnezu, jest związany ze stałymi wiązania każdego jonu. Kalmodulina może istnieć podczas wiązania z innymi jonami, takimi jak magnez, ale jeśli występuje wyższe stężenie wapnia, jony wapnia natychmiast konkurują z jonami magnezu, zajmując miejsca wiązania wapnia. Dzieje się tak, ponieważ stała wiążąca CaM i Ca2+ (Ka) jest większa niż stała wiążąca Cam i Mg2+, jak pokazano na fig. Oznacza to, że po związaniu z jonami wapnia kalmodulina wytwarzałaby więcej produktów. Należy wziąć pod uwagę wszystkie te idee pamiętając, że proces ten zachodzi niezliczone razy na sekundę, a obroty tego białka zmieniają się w odpowiedzi na stale modulowane stężenie wapnia w komórce.
dlaczego Wiązanie kalmoduliny z jonami wapnia jest korzystniejsze niż z innymi metalami? Może to być spowodowane wielkością jonów w stosunku do przeszkody sterycznej indukowanej przez ligandy. Miejsce wiązania charakteryzuje się 6 ligandami tworzącymi 7 wiązań współrzędnych. Ponieważ jony wapnia są większe niż jony magnezu, jak pokazano na fig.8, możliwe jest, że wapń jest preferowany, ponieważ zwiększa odległość ligandów od siebie, zmniejszając tym samym steryczne interakcje między ligandami. Sama struktura samego białka może również stanowić przyczynę selektywności jonów wapnia. Ogólnie rzecz biorąc, wiadomo, że dzięki termodynamice opartej na różnym stężeniu komórkowym jonów wapnia, kalmodulina wyczuje wzrost jonów, wiąże je i pomaga w realizacji swojej funkcji.
CaM + Ca2+ <–> Ca2+CaM (KCaM-Ca)
Cam + Mg2+ <–> Mg2+CaM (Kcam-Mg)
Mg2+-CaM + Ca2+ <–> Ca2+cam + Mg2+
ponieważ Kcam-ca > Kcam-mg
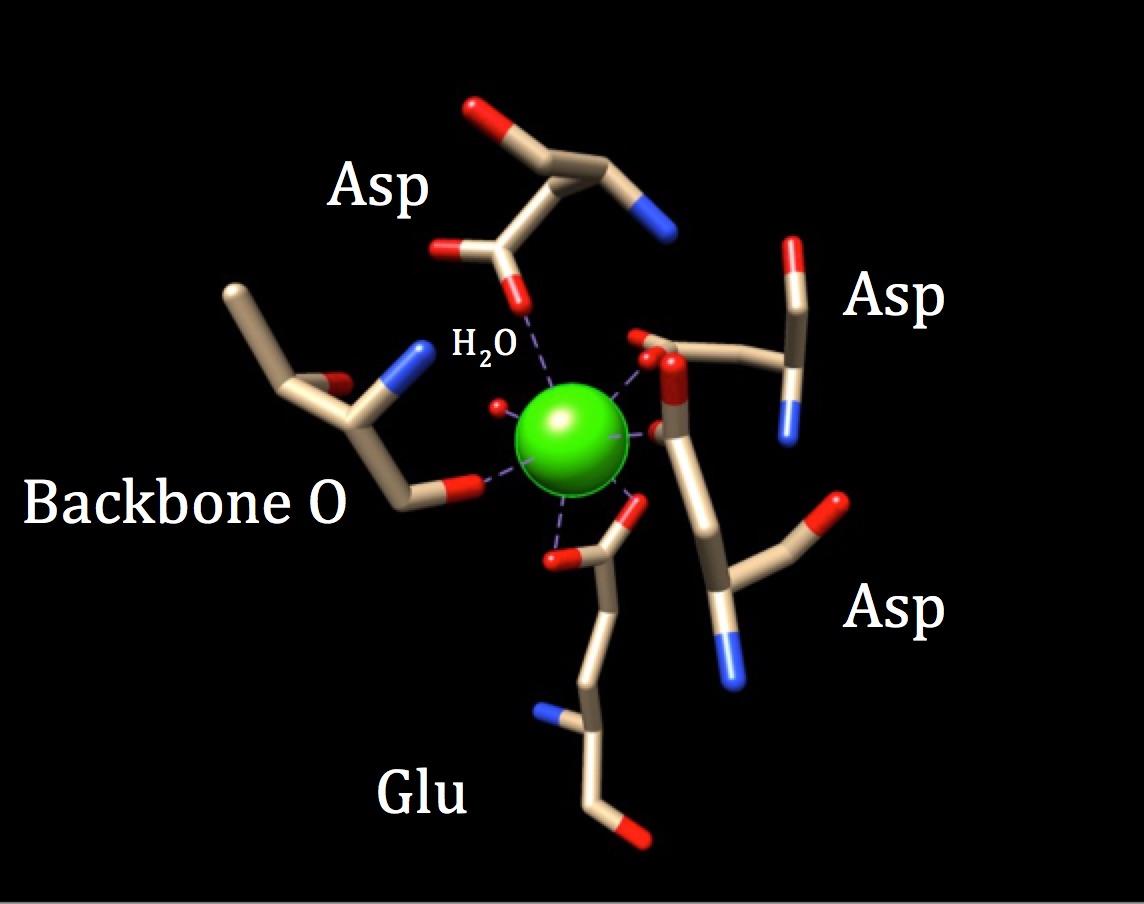
w dalszej dyskusji na temat chemii miejsca wiązania Kalmoduliny należy zbadać geometrię koordynacji. Ponieważ jon wapnia oddziałuje z siedmioma atomami dawcy, układ ten jest znany jako układ heptadentanowy. Ponieważ kalmodulina otoczona jest sześcioma ligandami, można przyjąć ośmiościanową geometrię koordynacyjną. Ale ponieważ jeden z ligandów oddziałuje w sposób bidentowy z Jonem-co oznacza, że ma dwa koordynacyjne wiązania kowalencyjne pochodzące z różnych atomów w jednym aminokwasie—kompleks koordynacyjny przybiera zniekształcony kształt oktaedryczny. Szczególna koordynacja została przedstawiona na poniższym rysunku.
geometria koordynacyjna miejsca wiązania wapnia kalmoduliny. Środkowy jon wapnia jest otoczony trzema asparaginami (Asp), jednym tlenem szkieletowym, jednym kwasem gluatowym (Glu) i jedną cząsteczką wody. (Kod PDB 3CLN)
możemy również odnieść się do teorii efektu chelatowego, aby lepiej zrozumieć zdolność kalmoduliny do wiązania się z jonami metali o wysokim powinowactwie. Chelator to atom, który jest w stanie wiązać się z więcej niż jednym atomem dawcy. Wiązanie polidentanowe jest związane z efektem chelatowym, który stwierdza, że gdy ligand wiąże się z wieloma grupami dawców (Poli), koordynacyjne wiązania kowalencyjne są znacznie silniejsze lub mocniej utrzymywane. Teoria ta jest wspierana przez termodynamikę, w szczególności, że Wiązanie polidentatu zwiększa entropię układu, czyniąc go bardziej pozytywnym (bardziej zaburzonym), co jest termodynamicznie korzystne. Zastosowanie tej teorii do kalmoduliny pomaga wyjaśnić nie tylko znaczenie wiązania polidendanu w samych miejscach, ale także potrzebę wiązania białka 4 różnych jonów wapnia w celu aktywacji jego funkcji. Zasadniczo wymagając wiązania czterech jonów Ca2+ w miejscach, system zachęca do wzrostu entropii poprzez wprowadzenie większej liczby substratów / reagentów w celu utworzenia większej liczby produktów. Dzieje się tak z powodu większej liczby wiązań w obrębie oddziaływań ligandowych każdego miejsca wiązania. Podsumowując, Wiązanie jonu wapnia w miejscach polipeptydu jest wspierane przez teorię efektu chelatowego i rzuca światło na skuteczność kalmoduliny w wiązaniu wapnia.
motywy EF-hand mają pewną strukturę opartą na tym, że wapń jest centralnym metalem. Dotyczy to również miejsc wiążących kalmodulinę. Jon Ca2+ wiąże się z podobnymi atomami w strukturach niektórych aminokwasów w oparciu o teorię zwaną twardą / miękką teorią kwasowo-zasadową. Teoria ta dzieli Metale i ligandy na dwie kategorie w oparciu o polaryzowalność i ich stosunek ładunku do promienia. Kwasy twarde i zasady są mniejszymi jonami, które mają większy stosunek ładunku do wielkości, co prowadzi je do interakcji w sposób elektrostatyczny (co oznacza przyciąganie między ładunkami + i–), podczas gdy miękkie kwasy i zasady są większe i dlatego mają mniejszy stosunek ładunku do promienia, prowadząc je do tworzenia wiązań o charakterze kowalencyjnym. Wyrażenie „like wiąże się z like” odnosi się do faktu, że twarde kwasy i zasady mają tendencję do interakcji z innymi twardymi atomami, i to samo dotyczy miękkich kwasów i zasad. Ca2+ charakteryzuje się twardym kwasem, ponieważ chociaż ma duży promień, oddziałuje z ligandami w sposób głównie elektrostatyczny. Patrząc na miejsce wiązania wapnia przez kalmodulinę, można zauważyć, że jon wapnia wiąże się z atomami tlenu 3 kwasów asparaginowych, kwasu glutaminowego, wody i karbonylu szkieletowego. Wiązanie to jest zgodne z „Podobne wiąże się z podobnym”, ponieważ woda i ligandy aminokwasów, kwas glutaminowy i kwas asparaginowy, wiążą się przez dawców tlenu, które są scharakteryzowane jako twarde zasady. 10 ponownie przedstawia miejsca wiązania kalmoduliny, jednocześnie pokazując ujemne łańcuchy boczne aminokwasów, które oddziaływałyby z jonami wapnia oznaczonymi na niebiesko.
w odniesieniu do atomów-dawców związanych ligandów i ich zdolności do oddawania par elektronów do kompleksu Koordynacyjnego, seria spektrochemiczna wyjaśnia, w jaki sposób Atomy oddziałują z centralnym metalem. W przypadku miejsca wiązania wapnia atomy tlenu wchodzące w interakcje z jonami Ca2+ są uznawane za σ-dawców i π-dawców, ponieważ atomy tlenu-dawców posiadają 2 lub więcej par elektronów. Kategorie seires spektrochemicznych, które określają dostępność i oddawanie elektronów mają wpływ na oznaczenie spinu (niski lub wysoki), który określa, jak elektrony d wypełniają swoje orbitale, i delta (Δ) Rozmiar między orbitalami d metalu, ale to nie ma znaczenia dla wapnia, ponieważ orbitale D wapnia są niezamieszkane z powodu braku elektronów walencyjnych D. To sprawia, że orbitale d są zasadniczo nieistotne w większości rozmów dotyczących białka. Jeden wyjątek dotyczy rozważenia labilności jonu wapnia w układzie.
brak elektronów w orbitalach Ca d daje zerową energię stabilizacji pola ligandowego i wyjaśnia wysoką labilność jonu wapnia. Labilność odnosi się do szybkości, z jaką ligandy mogą być zastępowane w kompleksach koordynacyjnych, a zatem opisuje kinetykę układu. Atomy są niestabilne, jeśli szybko wymieniają ligandy. Ze względu na swoją istotną funkcję we wszystkich komórkach eukariotycznych, oczekuje się, że kalmodulina wiąże i uwalnia jony wapnia miliony razy na sekundę w celu wysyłania i odbierania wiadomości z otaczających komórek poprzez przenoszenie jonów wapnia. Jeśli chodzi o zdolność kalmoduliny do szybkiego wiązania i uwalniania Ca2+, ważne jest rozważenie zajętości orbitali elektronowych valence D. Jak stwierdzono, wapń posiada puste orbitale valence D. Te niezamieszkane orbitale mogą dać wyjaśnienie labilności jonu Ca2+. Ponieważ wszystkie orbitale jonu wapnia są puste, posiada on energię stabilizacji pola ligandowego (lfse) równą 0. Oznacza to, że wapń jest niestabilny przy rozważaniu LFSE ze względu na fakt, że stabilne cząsteczki mają zwykle ujemną wartość dla LFSE. Niestabilność w tym przypadku przekłada się na gotowość do szybkiej reakcji i poruszania się i wyłączania kompleksów, co potwierdza twierdzenie, że jony Ca2+ zachęcają do szybkich reakcji i mogą być scharakteryzowane jako labilne. Chociaż wydaje się to sprzeczne z dyskusją dotyczącą efektu chelatu, rozumie się, że te dwie teorie nie są ze sobą sprzeczne. Stabilność ściśle utrzymywanych wiązań koordynacyjnych, sugerowana przez efekt chelatu, zachęca kalmodulinę do pozostania stabilną na tyle długo, aby wiązać białka suplementu. Po jego zakończeniu i stężenie wapnia wraca do normy, jest skuteczny w usuwaniu miejsca jonów wapnia.
Kalmodulina, opierając się na swojej strukturze i składzie witalnego miejsca wiązania, odgrywa integralną część niezliczonych procesów zachodzących w komórkach eukariotycznych. Poprzez przyjmowanie i wiązanie jonów wapnia w transdukcji sygnału, kalmodulina działa jako kluczowy składnik podstawowego i wysokiego poziomu funkcjonowania w organizmach takich jak ludzie. Stosując teorię bioorganiczną i rozumiejąc delikatnie monitorowane środowisko komórki eukariotycznej, można właściwie zrozumieć zdolność kalmoduliny do wyboru jonów wapnia i zachęcić do dalszego funkcjonowania z udziałem ponad 100 białek partnerskich.