Joniska elektrolyter
vatten och andra polära molekyler lockas till joner, som visas i Figur \(\PageIndex{2}\). Den elektrostatiska attraktionen mellan en jon och en molekyl med en dipol kallas en jon-dipolattraktion. Dessa attraktioner spelar en viktig roll vid upplösningen av joniska föreningar i vatten.
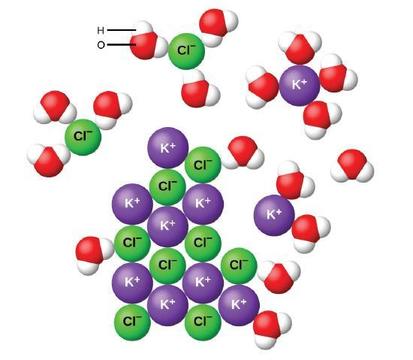
när joniska föreningar löses upp i vatten separeras jonerna i det fasta ämnet och sprids jämnt genom lösningen eftersom vattenmolekyler omger och löser jonerna, vilket minskar de starka elektrostatiska krafterna mellan dem. Denna process representerar en fysisk förändring som kallas dissociation. Under de flesta förhållanden kommer joniska föreningar att dissociera nästan helt när de löses, och så klassificeras de som starka elektrolyter.
Låt oss överväga vad som händer på mikroskopisk nivå när vi lägger fast KCl till vatten. Jon-dipolkrafter lockar den positiva (väte) änden av de polära vattenmolekylerna till de negativa kloridjonerna vid ytan av det fasta ämnet, och de lockar de negativa (syre) ändarna till de positiva kaliumjonerna. Vattenmolekylerna tränger in mellan enskilda K + och Cl− joner och omger dem, vilket minskar de starka interioniska krafterna som binder jonerna ihop och låter dem flytta till lösning som solvaterade joner, som figuren visar. Reduktionen av den elektrostatiska attraktionen tillåter den oberoende rörelsen av varje hydratiserad Jon i en utspädd lösning, vilket resulterar i en ökning av systemets störning när jonerna förändras från sina fasta och ordnade positioner i kristallen till mobila och mycket mer oordnade tillstånd i lösning. Denna ökade störning är ansvarig för upplösningen av många joniska föreningar, inklusive KCl, som löses upp med absorption av värme.
i andra fall är de elektrostatiska attraktionerna mellan jonerna i en kristall så stora, eller jondipolens attraktiva krafter mellan jonerna och vattenmolekylerna är så svaga att ökningen av störningen inte kan kompensera för den energi som krävs för att separera jonerna och kristallen är olöslig. Sådan är fallet för föreningar såsom kalciumkarbonat (kalksten), kalciumfosfat (den oorganiska komponenten i ben) och järnoxid (rost).