reaktioner i lösning som inte katalyseras är långsamma eftersom laddningsutveckling och separation sker i övergångstillståndet. När bindningar görs eller bryts bildas ofta laddade mellanprodukter som är högre i energi än reaktanterna. Eftersom mellanprodukten är högre i energi än reaktanterna, skulle övergångstillståndet vara ännu högre i energi och därmed mer likna den laddade mellanprodukten. Allt som kan stabilisera laddningarna på mellanprodukten och därmed utvecklingsladdningarna i övergångsstaterna kommer att sänka övergångsstatens energi och katalysera reaktionen. I detta avsnitt kommer vi att undersöka mekanismen bakom katalys av små molekyler av kemiska reaktioner. Förmodligen kommer biologisk makromolekylär katalysator (som proteinenzymer) att använda liknande mekanismer i deras katalytiska effekter (som kommer att diskuteras i nästa avsnitt).
katalysatorer, inklusive enzymer, kan använda minst 5 olika sätt att stabilisera övergångstillstånd.
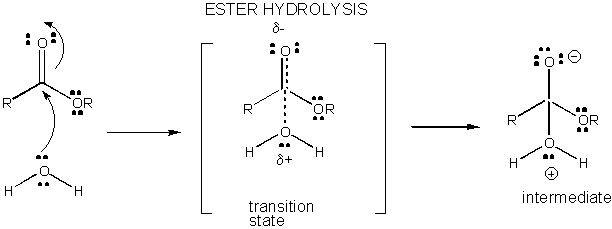
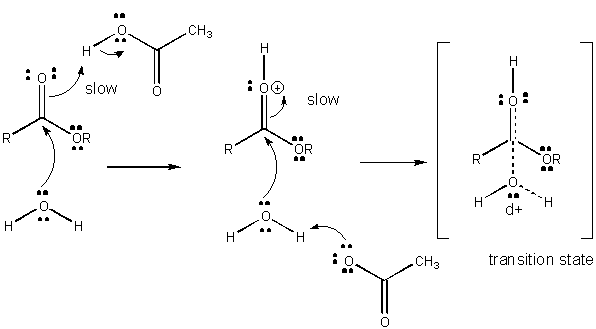
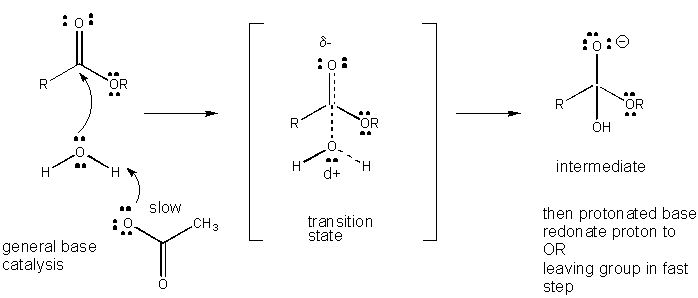
Laddningsutveckling i TS kan minskas genom antingen donation av en proton från allmänna syror (som ättiksyra eller en protonerad indolring) till en atom såsom en karbonyl O som utvecklar en partiell negativ laddning i TS när den är bunden av en nukleofil. Protondonation minskar det utvecklande negativa i TS. Alternativt kan en nukleofil såsom vatten som utvecklar en partiell positiv laddning i TS när den börjar bilda en bindning till en elektrofil C i en karbonyl stabiliseras genom närvaron av en allmän bas (såsom acetat eller den deprotonerade indolringen). Protonabstraktion minskar den utvecklande positiva laddningen
figur: LADDNINGSUTVECKLING i övergångstillståndet för ESTERHYDROLYS
figur: mekanism för allmän SYRAKATALYS
figur: mekanism för allmän BASKATALYS
bidragsgivare och attribut
- Prof. Henry Jakubowski (College of St. Benedict / St. John ’ s University)