- protokoll
- Hybridomproduktion
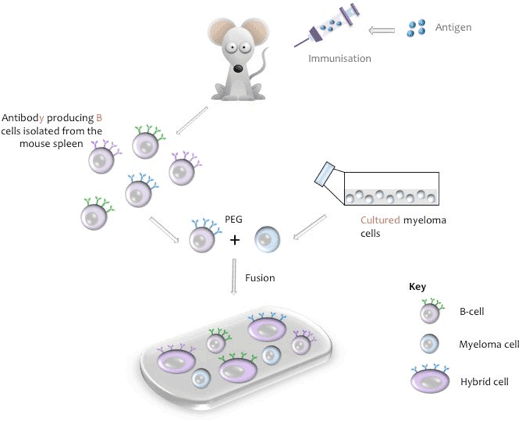
- Schematisk representation av cellfusion
- utrustning som behövs
- Medium och andra reagenser (se tillägg A för mer information)
- innan du börjar (se Bilaga A för mer information)
- upptining och tillväxt av myelomcellerna
- fusionsprocessen
- tre dagar innan – Förbered myelomcellerna för fusionen
- en dag innan-Förbered mediet
- fusionsdagen
- dag efter fusionen
- bilaga I
protokoll
Hybridomproduktion
en hybridom är en cellinje som härrör från en hybridcell som kan utsöndra en monoklonal antikropp specifik för en epitop av ditt antigen permanent i odling. Hybridcellen produceras genom fusion av specifik antikroppsproducerande B-cell från ett immuniserat djur (vanligtvis en mus, råtta eller kanin) och som har en ändlig livslängd, med en cell från en ”odödlig” odlad myelomcellinje (t.ex. mus NS-1 eller NS-0).
produktion av en mushybridcell
under fusionsprocessen isoleras B-celler från musmjälten, blandas med musmelomcellinjen och fusion induceras med polyetylenglykol (PEG, se bilaga I). (Den relevanta myelomlinjen används när B-celler från andra djurarter används). De resulterande hybridomerna odlas sedan i vävnadsodlingsmedium innehållande Hypoxatin, Aminopterin, tymidin (HAT), ett steg som dödar alla oanvända myelomceller som kan växa ut de andra svagare hybridomcellerna. Unfused B-celler har begränsade befogenheter division och kommer att dö av naturligt i kultur. Tio dagar efter fusionsprocessen samlas kultur supernatant och testas för närvaron av den önskade antikroppen.
Schematisk representation av cellfusion
utrustning som behövs
- en steril miljö, i vilken för att förbereda och hantera celler (laminärt flöde eller klass II skåp)
- en inkubator inställd på 37 ACC, med 5% CO2 och fuktighet av 95%
- ett inverterat mikroskop
- en 37 ACC vattenbad som kan placeras i skåpet
- en centrifug med en svängbar rotor
- sterila dissekeringsinstrument-helst två uppsättningar-var och en bestående av två par saxar och pincett (en krökt och en trubbig ände).
- 75 ml vävnad Corning kultur kolvar-Ref. 15430641
- 24 väl Falcon plattor-Ref. 353047
- sterila pipetter
- Pipettfyllmedel
- sterila pasteurpipetter
- en timer
Medium och andra reagenser (se tillägg A för mer information)
- rpmi 1640 bikarbonat buffrad, med L-Glutamin (Lonza Ref. BE12-702F)
- RPMI 1640 Hepes buffrad, utan L-Glutamin
- god kvalitet (batchtestad) fetalt bovint Serum (Genycell Ref. GCS0101-500)
- Penicillin / Streptomycin (Gibco Ref. 15070-063)
- Ultroser G (Pall Ref. 15950-017)
- hatt (Hypoxatin, Aminopterin, tymidin) (Gibco Ref. 21060-017)
- PEG 1500 (Roche Ref. 10783641001)
innan du börjar (se Bilaga A för mer information)
- gör 500 ml a
- gör 500 ml medium A+
- gör 100 ml medium B
- gör 100 ml medium C
- gör 500 ml medium D
upptining och tillväxt av myelomcellerna
Tina myelomcellinjen och växa i medium A. Använd följande metod för att tina och odla myelomcellinjen.
- ta bort den frysta injektionsflaskan med myelomceller från LN2-förvaringen.
- placera cellerna i ett vattenbad på 37 kg.
- håll locket på frysflaskan ovanför vattenytan för att minska risken för kontaminering.
- när cellerna nästan tinas (bara en liten bit is kvarstår) flyttar du till vävnadsodlingshuven.
- torka av utsidan av injektionsflaskan med 70% etanol och ta bort toppen.
- avlägsna försiktigt cellsuspensionen med en steril Pasteurpipett.
- överför innehållet till ett centrifugrör som innehåller 10 ml medium A (se tillägg a)
- snurra cellsuspensionen försiktigt vid 300 g i 5 minuter.
- ta bort supernatanten och återsuspendera cellerna i 10 ml färskt medium A och placera i en liten (25cm2) kolv.
- ta 1 ml av suspensionen från originalkolven och Lägg till en andra med 9 ml medium A. Detta säkerställer att om koncentrationen i den första kolven är för hög, finns en andra (lägre) koncentration av celler tillgänglig.
- sätt kolvarna i CO2-inkubatorn. Kom ihåg att lämna flasklocken något öppna för att möjliggöra gasutbyte.
fusionsprocessen
tre dagar innan – Förbered myelomcellerna för fusionen
myelomcellerna måste vara i exponentiell tillväxtfas när du använder dem och detta behöver erfarenhet. Men om du ställer in två 75 cm2-kolvar i dina myelomceller, en vid en utspädning av 1:40 och en vid 1:60 (se nedan), 3 dagar före fusionen bör en av kolvarna vara idealisk på fusionsdagen. (Inledningsvis ställa in ytterligare kolvar vid utspädningar över och under de som ges här bör ge dig den erfarenhet som krävs bedöma tillväxten av myelomcellerna för efterföljande fusioner).
en dag innan-Förbered mediet
följande måste göras och förvärmas till 37 OCCC (du kan lägga dem i din inkubator över natten).
- två x 200 ml medium A+ i två 75cm2 kolvar
- 100 ml medium B
- 100 ml medium C
- 1×4 ml PEG 1500 överförd till en folie insvept (PEG är ljuskänslig) steril universell
- en mini vattenbad, tillverkad av en 200 ml bägare som innehåller cirka 100 ml destillerat vatten och korsad med tejp tillräckligt bred så att det finns en öppning för att hålla ett 50 ml falconrör upprätt
fusionsdagen
- döda musen (enligt institutionella riktlinjer), extrahera mjälten och lägg den i en steril behållare som innehåller 5 ml medium C.
- alla efterföljande steg måste utföras i en laminär flödeskåpa.
- sätt mjälten och mediet i en petriskål.
- flytta mjälten med sterila pincett för att tvätta den. Ta bort eventuella vidhäftningar och överför mjälten till en andra petriskål
- skär mjälten i två. Håll ena halvan med trubbiga pincett och använd ett annat par böjda pincett, reta försiktigt cellerna ut från mjältkapseln och var noga med att ta bort så många celler som möjligt. Upprepa med den andra halvan av mjälten
- ta bort mjältkapselskräpet och blanda cellerna väl men mycket försiktigt med en steril Pasteurpipett.
- överför cellsuspensionen till ett 15 ml rör och använd ytterligare 5 ml medium C för att skölja petriskålen och Lägg till mjältcellerna i röret.
- räkna myelom och mjältceller.
- du behöver ett förhållande på 1 myelomcell till varje 10 mjältceller
- Lägg till myelomcellerna i ett 50 ml koniskt rör.
- Centrifugera både mjältcellerna (15 ml rör) och myelomcellerna i (50 ml rör) i 300 g i 10 minuter.
- häll mycket försiktigt av supernatanten i båda rören och försiktigt resuspendera pelletsna vardera i 10mls medium B. frånvaron av FBS tills fusionsprocessen är klar är extremt viktig eftersom cellerna inte kommer att smälta om det finns FBS närvarande)
- kombinera den resuspenderade mjältcellen och myelompellets i ett 50 ml centrifugrör.
- Centrifugera i 5 minuter vid 300g.
- häll försiktigt av så mycket supernatant som möjligt.
- Återsuspendera pelleten genom att försiktigt knacka på röret på bänken. Inte snärta pelleten eller pipett det eftersom detta kommer att distribuera celler upp runt röret minska celltal som är tillgängliga för fusing.
- placera röret i det hemlagade vattenbadet.
- tillsätt 1,2 ml PEG droppe för droppe under en minut, rör om försiktigt med några droppar.
- tillsätt 1 ml medium B, droppe för droppe under en minut, rör om försiktigt med några droppar.
- tillsätt ytterligare 2 ml medium B, droppe för droppe under två minuter, rör om försiktigt med några droppar.
- tillsätt ytterligare 4 ml medium B, droppe för droppe under fyra minuter, rör om försiktigt med några droppar.
- vid slutet av tiden, tillsätt 8 ml medium C.
- Centrifugera röret av celler för 5 minuter 300g.
- mycket försiktigt dekantera supernatanten och resuspendera cellpelleten för 1 minut med 10 ml medium A+. För att göra detta, tillsätt några ml av mediet för att börja bryta upp pelleten. Sug upp dessa klumpar av celler mycket försiktigt och rör dig upp och ner i pipetten. Utvisa dessa celler och upprepa processen. Var väldigt försiktig, tvinga inte pelleten isär, du kan ha små klumpar av celler när du är klar. Cellerna är extremt bräckliga i detta skede.
- Lägg 10 ml resuspenderad fusionsblandning i 190 ml varmt medium A+
- den slutliga volymen är 200 ml
- Lägg 1 ml av denna suspension i varje brunn med 8 x 24 brunnar (2 ml) plattor. (192 brunnar totalt)
- lämna plattorna i inkubatorn över natten (ungefär 24 timmar).
dag efter fusionen
- tillsätt 8 ml hatt i 200 ml medium A+.
- Lägg 1 ml av detta selektiva medium i varje brunn på de 8 plattorna.
- lämna plattorna i inkubatorn. Kolonierna kommer att visas mellan 7 till 10 dagar

bilaga I
odlingsmedium A:
RPMI 1640 medium med L-Glutamin (bikarbonatbuffrad) (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100u/ml)/Streptomycin (100 mg/l) (Gibco Ref. 15070-063)
Odlingsmedium A+:
RPMI 1640 medium with L-Glutamine (bicarbonate buffered) (Lonza Ref. BE12-702F)
+10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
+ Ultroser G (1%) (Pall Ref. 15950-017)
Culture Medium B (no FBS):
RPMI 1640 Medium with L-Glutamine (Lonza Ref. BE12-702F)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
Culture Medium C:
RPMI 1640 Medium with L-Glutamine (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
Culture Medium D:
RPMI 1640 medium with L-Glutamine (bicarbonate buffered) (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
+ Ultroser G (1%) (Pall Ref. 15950-017)
+ HAT (Hypoxathine, Aminopterin, Thymidine) supplement which is usually 50X (dilute 10ml in 500mls of medium) (Gibco Ref. 21060-017)