- plasticitet av VSMCs i fysiologi och sjukdom
- VSMCs påverkar adventitia immunsvar hos hyperlipidemiska möss
- åldrande eller kronicitet eller båda?
- nybildade adventitia-strukturer deltar i atlo-funktionen genom att främja Lymfocytrecirkulation
- Atlo-bildning är mycket Territorialiserad vilket indikerar att signaler överförs från plack till Adventitia via lymfoid Vävnadsorganisatörliknande VSMCs
- VSMCs bidrar direkt till Adventitiaimmunitet vid ateroskleros
- slutsats
- Författarbidrag
- finansiering
- intressekonflikt uttalande
plasticitet av VSMCs i fysiologi och sjukdom
vaskulära glatta muskelceller (VSMCs) är de viktigaste beståndsdelarna i medelstora och stora artärer. Även om mekanismer för aterogenes till stor del återstår att definieras har studier visat att sjukdomsprogression involverar överhörning mellan immunceller med både ECs och VSMCs. Några av dessa interaktioner främjar placktillväxt medan andra dämpar storleken, cellkompositionen och stabiliteten hos aterosklerotiska plack (1, 2) (Figur 1, Tabell 1). VSMCs visar anmärkningsvärd plasticitet som svar på vaskulär skada, inflammation och lipoproteinackumulering under sjukdomsprogression via omprogrammering av genuttryck och en övergång till en proliferativ, Pro-migrerande och aktiverad fenotyp, dvs fenotypbyte (5). I Figur 1, Vi visar kritiska molekylära omkopplare som har föreslagits vara viktiga regulatorer för sjukdomsprogression (3, 6, 8, 11). Under åderförkalkning initiering, blod härledda monocyter, som har rekryterats i intima, ackumuleras lipid ger dem en skummande utseende. Dessa skumceller bidrar till fettstreckbildning som utgör det tidigaste och eventuellt reversibla stadiet av aterosklerotiska plack. Feta streck utvecklas gradvis till atheromer / plack som slutligen leder till expanderade plack som innehåller VSMCs, T-celler och myeloida celler (Figur 1) (33). Intriguingly bestämmer sammansättningen av en aterosklerotisk plack snarare än dess storlek dess stabilitet, eftersom fibrös locktjocklek och nekrotisk kärnstorlek är potentiella kännetecken för en stabil respektive en instabil plack (4, 9). VSMCs i intima skiktet ses traditionellt som fördelaktigt under aterogenes eftersom de producerar extracellulära matriskomponenter, vilket främjar bildandet av starkare fibrösa kepsar vilket resulterar i skydd mot plackbrott (4, 9). Det är allt tydligare att VSMCs genomgår en uppsjö av strukturella och funktionella fenotypiska transformationer och kan till och med helt förlora sina inhemska egenskaper för att förvärva egenskaper hos andra celltyper inklusive makrofager. Data indikerar att VSMCs kan förvärva dikotomiska fenotyper med en Janus huvudtyp, dvs pro-vs. anti-atherogena egenskaper, beroende på vävnadsmiljö och verkan av riskfaktorer (3). VSMCs frigör cytokiner för att stimulera intilliggande ECs för att uttrycka vidhäftningsmolekyler och frigöra cytokiner och/eller förbättra kemotaxi av monocyt/makrofager i plack (3, 34, 35) (Tabell 1). Dessa data indikerar att ackumulering av VSMCs i fibrösa locket eller intima är fördelaktiga, medan deras förlust eller övergång till en inflammatorisk fenotyp är skadlig, och att balansen mellan vsmcs proliferation/migration vs. död/senescens bestämmer ateroprogression vs. plackstabilitet (3). Olika ytterligare aspekter av vsmc-biologi i hälsa och sjukdom täcktes nyligen av en serie utmärkta recensioner (https://academic.oup.com/cardiovascres/issue/114/4) och kommer inte att täckas här. Nedan fokuserar vi därför på adventitias roll och vsmcs potentiella inverkan på ATLO-bildandet.

Figur 1. Fenotyper av VSMCs under ateroskleros progression avslöjar extraordinär plasticitet. ECs och VSMCs i aterosklerotiska plack visar aktiverade fenotyper (DB) (3, 4). Några av Vsmc: erna har sitt ursprung i media efter rekrytering till intima; andra Vsmc: er kan vara benmärgs-härledda eller de kan härröra från myeloida celler i cirkulationen (XX) (3). En bråkdel av VSMCs proliferera (Januari) (3, 5). VSMCs utsöndrar extracellulära matriskomponenter; den pluripotenta transkriptionsfaktorn, dvs Klf4, kan spela viktiga roller i en process som kallas fenotyp switching (XX) (6, 7). I försök att skydda den aterosklerotiska placken från dödlig bristning kan Oct4 styra en process som har kallats remigration för att bilda en fibrös keps (xnumx) (4, 8-10). Senescens och apoptos utlöser genereringen av ytterligare inflammatoriska cytokiner för att bilda en nekrotisk kärna som initierar en ond cirkel med dödliga kliniska konsekvenser under de sena stadierna av sjukdomen (PPF) (3, 4, 11).
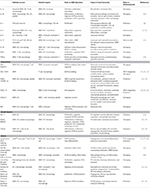
Tabell 1. Viktiga inflammatoriska mediatorer involverade i vsmc-medierad ateroskleros immunitet.
VSMCs påverkar adventitia immunsvar hos hyperlipidemiska möss
under de senaste två decennierna blev det alltmer uppenbart att adventitia är en mycket komplex och immunologiskt aktiv vävnad som rymmer celler så olika som stromaceller, nerver, lymfkärl, vasa vasora och bosatta leukocyter/stamceller som alla har förmågan att påverka sjukdomsframsteg (36, 37). Vi observerade att adventitia av ApoE – / – möss genomgår stora omstruktureringshändelser under alla stadier av ateroskleros: Både medfödda och adaptiva immunceller ackumuleras intill de närliggande aterosklerotiska plackarna (Figur 2). Dessutom bekräftades våra studier i experimentella möss i mänskliga sjuka artärer: vi och andra observerade ATLO-liknande strukturer i adventitia hos patienter som presenterade aterosklerotiska aortaaneurysmer (38, 39) och mer nyligen Akhavanpoor et al. observerade välutvecklade ATLOs i adventitia hos en betydande andel patienter som drabbats av ischemisk hjärtsjukdom (40). Vid Murin ateroskleros är lymfkärl-, hög endotel venule (HEV) – och blodkärlsneogenes framträdande drag i denna omstruktureringsprocess (16, 41).
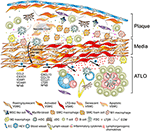
Figur 2. Vaskulära glatta muskelceller (VSMC) deltar i adventitiaimmunitet under plackbildning. VSMCs inklämt mellan aterosklerotiska plack och adventitia anta en lymfoid vävnad arrangör-liknande fenotyp efter aktivering via plack-härledda signaler (XX) och därefter transdifferentiera in i LTo-liknande celler (XX). Med hjälp av deras proliferativa och cytokinuttryckande fenotyp påverkar de omstruktureringen och skulpteringen av adventitia inklusive angiogenes, HEV-bildning och lymfkärlneogenes (SEF). Fenotypomkoppling resulterar också i uttryck och utsöndring av lymforganogena kemokiner, dvs CXCL13 och CCL21, vilket främjar ATLO-bildning avbildad schematiskt i den nedre delen av grafen (XX).
åldrande eller kronicitet eller båda?
viktigt är att åldrande visade sig vara en viktig determinant för adventitia omstrukturering och skulptur. Fullt utvecklad ATLOs form under avancerade stadier av ateroskleros men deras tidiga stadier, dvs t / B-cellaggregat, framträder parallellt med bildandet av aterosklerotiska plack (16, 27, 41, 42). Faktum är att dessa tidiga ATLOs bildas vid en ålder av ~30 veckor och når mer avancerade stadier vid cirka 52 veckor till topp vid 78 veckor (16, 41). Liknande åldersberoende utvecklingsstadier av TLOs har observerats i andra kroniska olösliga sjukdomar (1, 42). Dessa data indikerar att ATLO-utvecklingen är åldersberoende och åldrande är positivt förknippat med adventitial skulptering (Figur 2). Förhållandet mellan åldrande och kronicitet är emellertid svårt att studera i Murin ateroskleros, eftersom aterosklerotisk plackutveckling börjar i aortabågen och sedan färdas sådd aorta för att nå bukaorta vid senare sjukdomsstadier och tar därmed längre tidsperioder. Mer arbete behövs för att klargöra den viktiga frågan om immuncell och / eller vsmc-senescens bidrar till ATLO-bildning och vilka celltyper, dvs., VSMCs, ECs och/eller immunceller är involverade. Studier i andra former av TLO-bildning, såsom de som förekommer i lungan och mag-tarmkanalen, skulle indikera att det är kroniciteten hos en ihållande inflammatorisk vävnadsreaktion snarare än bona fide åldrande händelser i immunsystemet som väsentligt bidrar till bildandet av ATLOs (43, 44).
nybildade adventitia-strukturer deltar i atlo-funktionen genom att främja Lymfocytrecirkulation
avancerade ATLO-steg inkluderar T/B-cellaggregat, germinala centra inom aktiverade B-cellfolliklar, lymfkärl, hev i t-cellområden och extracellulära ledningsnätverkverk (16). Dessa stora förändringar liknar strukturer som påminner om de som finns i sekundära lymfoida organ där de främjar grundläggande aspekter av immunsvar mot antigen inklusive recirkulation av Na-lymfocyter för att hitta deras kognitiva antigener/autoantigener och organisera affinitetsmognad av B-celler mot potentiella autoantigener. Med hjälp av adoptiv lymfocytöverföringsstudier observerade vi att ATLOs kraftigt förbättrar lymfocytrekrytering i artärväggen genom att både främja invandring och samtidig dämpning av utvandring av antigen-oerfarna lymfocyter (27). Efter deras rekrytering aktiveras T-celler, börjar proliferera och några av CD4 T-hjälparcellerna omvandlas till inducerade T-regulatoriska celler. Dessa data avslöjar att immunsystemet i adventitia är mycket lyhörd mot den underliggande inflammatoriska vävnadsreaktionen i artärväggen. Dessutom verkar B-celler som bildar germinala centra i aktiverade B-cellfolliklar genomgå en germinal center-reaktion i närvaro av follikulära dendritiska celler där vissa omvandlas till minne B-celler medan andra lämnar germinala centra för att bli plasmaceller (45). När de tas tillsammans indikerar dessa data att ATLOs snarare än sekundära lymfoida organ (som tidigare trott) organiserar åderförkalkning immunitet.
Atlo-bildning är mycket Territorialiserad vilket indikerar att signaler överförs från plack till Adventitia via lymfoid Vävnadsorganisatörliknande VSMCs
en annan aspekt av adventitia-omstrukturering under aterogenes är att ATLO-bildning är mycket territorialiserad och är till stor del begränsad till adventitia-segment intill aterosklerotiska plack i abdominal aorta hos möss (16, 45). ATLOs finns bara ibland i adventitia i innominatartären eller i aortabågen där ateroskleros är mest framträdande. Immunceller i bröstkorgsegmenten i aortan består huvudsakligen av T-cellaggregat jämfört med ATLOs i buken aorta (16, 41). Den exakta mekanismen för territorialitet av atlos-bildning i buken aorta är fortfarande okänd. TLOs verkar vara en egenskap hos många kroniska olösliga inflammatoriska sjukdomar och är framträdande kännetecken för autoimmuna sjukdomar (42). Cellulariteten och strukturerna hos TLOs vid ateroskleros liknar TLOs i många andra kroniska sjukdomar inklusive cancerassocierad TLO-bildning (46, 47). Fältet för TLO-biologi har dramatiskt expanderat de senaste åren och ökat den viktiga möjligheten att nytt terapeutiskt mål kan identifieras via förståelse för TLO: s funktion i var och en av TLO-associerade sjukdomar. De olika typerna av TLOs avslöjar emellertid vissa sjukdomsspecifika egenskaper, vilket i slutändan kan avgöra om de associerade immunsvaren är skadliga eller skyddande. Sådana sjukdomsspecifika egenskaper uppstår eventuellt genom en av flera mekanismer inklusive organspecificitet och arten av vävnadsskada (1, 42). Utvecklingen av lymfoida organ är en komplex process som involverar hematopoietiska lymfoidvävnadsinducerare (LTi)-celler, icke-hematopoietiska stromala lymfoidvävnadsorganisatör (LTo) – celler och Lt Askorbr-signalering. Våra in vitro-studier av mus aorta VSMCs indikerade att de vid lämplig stimulering kan fungera som LTo-liknande celler (20), som ursprungligen identifierades under embryonal utveckling under bildandet av sekundära lymfoida vävnader inklusive lymfkörtlar och mjälte (48, 49) (se nedan). Det är viktigt att notera att ATLOs verkar involvera VSMCs som viktiga deltagare medan andra TLOs involverar andra LTo-liknande mesenkymala celler (50). Den gemensamma nämnaren för alla former av Tlos verkar emellertid vara–till skillnad från sekundära lymfoida organ–en kronisk inflammatorisk vävnadsreaktion som driver immunsystemet för att bilda dessa lymfoida strukturer nära eller i vissa fall inom den sjuka vävnaden (42, 43).
VSMCs bidrar direkt till Adventitiaimmunitet vid ateroskleros
med tanke på den mycket territorialiserade naturen hos ATLOs intill aterosklerotiska plack resonerade vi att VSMCs kan vara involverade i ATLO-bildning och på samma sätt kan anta en funktionell roll vid ateroskleros progression. VSMCs uttrycker högt Lt UIR konstitutivt (16), medan dess ligand Lta1 UI2 uttrycks på olika immunceller som kallas LTi-celler (51). Vsmc: er antas aktiveras genom Lt-signalvägen av LTI-celler involverade i sekundär lymfoid vävnadsneogenes. Lti-cellens ursprung har ännu inte fastställts tydligt men aktiverade makrofager och andra immunceller i intima plack är kandidater för denna aktivitet vid LTO-neogenes. Som svar på cellulära och lösliga mediatorer verkar VSMCs genomgå en distinkt typ av fenotyp som byter till en LTo-liknande fenotyp genom parakrinsekretion av de lymforganogena kemokinerna, dvs CXCL13 och CCL21, vilket lockar immunceller, t.ex. makrofager/dendritiska celler, T-celler och B-celler till den lokala adventitia-miljön som leder till bildning av ATLO i adventitia (27, 41, 45) (Tabell 1). Global eller VSMC-specifik brist på Lt UBR i åldrade hyperlipidemiska ApoE – / – möss visade ökad aterosklerotisk plackbildning vilket indikerar att Vsmc Lt UBR har förmågan att dämpa utvecklingen av ateroskleros under vissa experimentella förhållanden (27). Andra studier visade emellertid att unga globala ApoE – / – LTbR – / – möss som upprätthölls under en hög fetthalt (HFD) avslöjade en lägre aortaplackbörda än deras normala Dietmatade ApoE-/− motsvarigheter (52). Dessa uppenbara motsägelsefulla data tyder på att rollerna för Lt Usbr hos unga möss och under förhållanden med överdriven hyperlipidemi kan vara olika i de två modellerna. Alternativt kan den höga fettdieten som leder till dramatiska och eventuellt berusande nivåer av plasmalipider vara ansvarig för dessa skillnader. Eftersom vi inte regelbundet använder en fettrik diet i ApoE – / – möss, förblir dessa skillnader olösta problem, men det har visat sig att immunsystemet kan bli överväldigat av extrema nivåer av plasmalipider . Dessa data kräver ytterligare studier för att undersöka den molekylära grunden för den uppenbara dikotomin av Lt Usbr vid ateroskleros progression hos unga vs. åldrade möss och/eller tidig vs. avancerad ateroskleros. Dessutom kan benmärgs-härledda makrofager fungera som Lt-Tuberkulosoberoende Lti-celler och utlösa uttrycket av CCL19, CCL20 och CXCL16 av VSMCs (53) (Tabell 1). Således kan VSMCs delta i bildandet av TLOs vid ateroskleros genom uppreglering av lymforganogena kemokiner för att främja immuncellaggregat i adventitia. Som nämnts ovan är ATLOs vanliga hos människor belastade av ischemisk kranskärlssjukdom (40) och hos humana aterosklerotiska aortaaneurysmer (38, 39). När det tas tillsammans väcker förekomsten av ATLOs i experimentella möss och i mänsklig ateroskleros viktiga frågor angående arten av ateroskleros som en autoimmun sjukdom: det är tänkbart att under aterogenes genereras autoimmuna T-celler och autoimmuna B-celler riktade mot ännu inte identifierade autoantigener. Isolering av sådana autoimmuna lymfocyter inklusive sekvensering av deras T-cellreceptorer och/eller B-cellreceptorer skulle tillåta att testa stora hypoteser vid ateroskleros. Faktum är att aterosklerosforskning skulle genomgå en stor förändring och testning av enskilda autoimmuna lymfocytkloner i funktionella in vitro och in vivo-system skulle bli möjliga.
slutsats
ateroskleros är en inflammatorisk sjukdom i artärerna. VSMCs kommunicerar med både ECs och immunceller i aterosklerotiska plack och bosatta celler i adventitia. Denna förmåga gör det möjligt för VSMCs att påverka åderförkalkning immunitet på stora sätt inklusive bildandet av ATLOs. Ytterligare arbete krävs för att avgränsa vsmcs roll under olika stadier av ateroskleros, bestämma deras roll i unga vs. åldrande artärer och belysa ytterligare deras dikotomiska roller i sjukdomsprogression. En bättre förståelse av dessa processer kan öppna vägen för att utveckla terapeutiska strategier för framtida ingrepp i kliniskt viktiga sena stadier av sjukdomen.
Författarbidrag
alla författare bidrog till utformningen, skrivandet och redigeringen av det inlämnade manuskriptet och godkände det för publicering.
finansiering
intressekonflikt uttalande
författarna förklarar att forskningen genomfördes i avsaknad av kommersiella eller finansiella relationer som kan tolkas som en potentiell intressekonflikt.
4. Det är en av de mest populära och mest populära spelen i världen. Apoptos av vaskulära glatta muskelceller inducerar egenskaper hos placksårbarhet vid ateroskleros. Nat Med. (2006) 12:1075–80. doi: 10.1038 / nm1459
PubMed Abstrakt / CrossRef fulltext / Google Scholar
5. Owens GK, Kumar MS, Wamhoff BR. Molekylär reglering av vaskulär glattmuskelcelldifferentiering vid utveckling och sjukdom. Physiol Rev. (2004) 84:767-801. doi: 10.1152/physrev.00041.2003
PubMed Abstrakt / CrossRef Fulltext / Google Scholar
6. Ls, Gomez D, Cherepanova OA, lax M, Alencar GF, Haskins RM, et al. KLF4-beroende fenotypisk modulering av glatta muskelceller har en nyckelroll i aterosklerotisk plackpatogenes. Nat Med. (2015) 21:628–37. doi: 10.1038 / nm.3866
PubMed Abstrakt / CrossRef Fulltext / Google Scholar
7. Gomez D, Owens GK. Glattmuskelcellfenotypisk växling vid ateroskleros. Cardiovasc Res. (2012) 95:156-64. doi: 10.1093 / CVR | cvs115
PubMed Abstrakt / CrossRef fulltext / Google Scholar
8. L. A., L. A., L. A., L. A., L. A., L. A., L. A., L. A., L. A., L. A., L. A., L. A., L. A. Aktivering av pluripotensfaktorn OCT4 i glatta muskelceller är ateroprotektiv. Nat Med. (2016) 22:657–65. doi: 10.1038 / nm.4109
PubMed Abstrakt / CrossRef Fulltext / Google Scholar
10. J. A., J. A., J. A., J. A., J. A., J. A., M. A., M. A., M. A., M. A., M. A., M., M., M., M., M., M., M. Stabilisering av aterosklerotiska plack. Position paper av European Society of Cardiology (ESC) arbetsgrupp för åderförkalkning och vaskulär biologi. Thromb Hemost. (2011) 106:1–19. doi: 10. 1160 / TH10-12-0784
PubMed Abstrakt / CrossRef fulltext / Google Scholar
11. Han är en av de mest kända och mest kända i världen. Vaskulär glatt muskelcelldöd, autofagi och senescens vid ateroskleros. Cardiovasc Res. (2018) 114:622-34. doi: 10.1093 / CVR | cvy007
PubMed Abstrakt / CrossRef fulltext / Google Scholar
14. Det är en av de mest populära och mest populära. De två ansikten av Interleukin – 17a vid ateroskleros. Curr Läkemedelsmål. (2017) 18:863–73. doi: 10.2174/1389450117666161229142155
PubMed Abstrakt / CrossRef fulltext / Google Scholar
15. Jia G, Cheng G, Gangahar DM, Agrawal DK. Insulinliknande tillväxtfaktor – 1 och TNF-alfa reglerar autofagi genom c-jun N-terminal Kinas och Akt-vägar i humana aterosklerotiska vaskulära släta celler. Immunol Cell Biol. (2006) 84:448–54. doi: 10.1111 / j. 1440-1711. 2006.01454.X
PubMed Abstrakt / CrossRef fulltext / Google Scholar
16. Det finns många olika typer av produkter. Lymfotoxin beta-receptorsignalering främjar tertiär lymfoid organogenes i aorta adventitia hos åldrade ApoE−/− möss. J Exp Med. (2009) 206:233–48. doi: 10.1084 / jem.20080752
CrossRef Fulltext / Google Scholar
17. Han är en av de mest kända och mest kända. Förbättrat uttryck av de homeostatiska kemokinerna CCL19 och CCL21 i klinisk och experimentell ateroskleros: möjlig patogen roll vid plackdestabilisering. Arterioscler Tromb Vasc Biol. (2007) 27:614–20. doi: 10.1161 / 01.FYRHJULING.0000255581.38523.7c
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Doring Y, Noels H, van der Vorst EPC, Neideck C, Egea V, Drechsler M, et al. Vascular CXCR4 limits atherosclerosis by maintaining arterial integrity: evidence from mouse and human studies. Circulation. (2017) 136:388–403. doi: 10.1161/CIRCULATIONAHA.117.027646
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Akhtar S, Gremse F, Kiessling F, Weber C, Schober A. CXCL12 promotes the stabilization of atherosclerotic lesions mediated by smooth muscle progenitor cells in Apoe-deficient mice. Arterioscler Thromb Vasc Biol. (2013) 33:679–86. doi: 10.1161/ATVBAHA.112.301162
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Lotzer K, Dopping S, Connert S, Grabner R, Spanbroek R, Lemser B, et al. Mouse aorta smooth muscle cells differentiate into lymphoid tissue organizer-like cells on combined tumor necrosis factor receptor-1/lymphotoxin beta-receptor NF-kappaB signaling. Arterioscler Thromb Vasc Biol. (2010) 30:395–402. doi: 10.1161/ATVBAHA.109.191395
PubMed Abstrakt / CrossRef Fulltext / Google Scholar
21. Smedbakken LM, Halvorsen B, Daissormont I, Ranheim T, Michelsen AE, Skjelland M, et al. Ökade nivåer av homeostatisk kemokin CXCL13 i human ateroskleros-potentiell roll i plackstabilisering. Åderförkalkning. (2012) 224:266–73. doi: 10.1016 / j.ateroskleros.2012.06.071
CrossRef Fulltext / Google Scholar
22. J. A., J. A., J. A., J. A., J. A., J. A., J. A., J. A., J. A., J. A., J. A., J. A. Insulinliknande tillväxtfaktor – 1-receptorbrist i makrofager accelererar ateroskleros och inducerar en instabil plackfenotyp i apolipoprotein E-bristfälliga möss. Omsättning. (2016) 133:2263–78. doi: 10.1161 / CIRCULATIONAHA.116.021805
PubMed Abstrakt / CrossRef Fulltext / Google Scholar
23. Alexander MR, Owens GK. Epigenetisk kontroll av glattmuskelcelldifferentiering och fenotypisk omkoppling i vaskulär utveckling och sjukdom. Annu Rev Physiol. (2012) 74:13–40. doi: 10.1146 / annurev-physiol-012110-142315
PubMed Abstrakt / CrossRef fulltext / Google Scholar
24. Han C, Medley SC, hu T, Hinsdale mig, Lupu F, Virmani R, et al. Pdgfrbeta-signalering reglerar lokal inflammation och synergiserar med hyperkolesterolemi för att främja ateroskleros. Nat Commun. (2015) 6:7770. doi: 10.1038 / ncomms8770
PubMed Abstrakt / CrossRef fulltext / Google Scholar
26. Det finns många olika typer av produkter. Inriktning på Interleukin – 1beta skyddar mot Aortaaneurysmer inducerade av störd transformerande tillväxtfaktor beta-signalering. Immunitet. (2017) 47:959-73 e9. doi: 10.1016 / j.immuni.2017.10.016
CrossRef Fulltext / Google Scholar
27. Hu D, Mohanta SK, Yin C, Peng L, Ma Z, Srikakulapu P, et al. Artär tertiära lymfoida organ kontrollerar aortaimmunitet och skyddar mot ateroskleros via vaskulära glattmuskelcelllymphotoxin beta-receptorer. Immunitet. (2015) 42:1100–15. doi: 10.1016 / j.immuni.2015.05.015
PubMed Abstrakt / CrossRef Fulltext / Google Scholar
29. L, Strawbridge RJ, Halvorsen B, Yndestad A, Ranheim T, et al. NLRP3 inflammasomuttryck och aktivering vid Human ateroskleros. J Am Hjärta Assoc. (2016) 5:e003031. doi: 10.1161/JAHA.115.003031
CrossRef Fulltext / Google Scholar
30. de Jong RJ, Paulin N, Lemnitzer P, Viola JR, vinter C, Ferraro B, et al. Skyddande lämplighet för annexin A1 i arteriell neointima-bildning i aterosklerosbenägna möss-kort rapport. Arterioscler Tromb Vasc Biol. (2017) 37:312–5. doi: 10.1161/ATVBAHA.116.308744
CrossRef Fulltext / Google Scholar
32. han är en av de mest populära och mest populära i världen. Den neuroimmuna vägledningen cue netrin-1 främjar ateroskleros genom att hämma utvandringen av makrofager från plack. Nat Immunol. (2012) 13:136–43. doi: 10.1038 / ni.2205
CrossRef Fulltext / Google Scholar
35. Tchkonia T, Zhu Y, van Deursen J, Campisi J, Kirkland JL. Cellulär senescens och senescent sekretorisk fenotyp: terapeutiska möjligheter. J Clin Investera. (2013) 123:966–72. doi: 10.1172 / JCI64098
PubMed Abstrakt / CrossRef fulltext / Google Scholar
37. Lu s, Regan JN, Bagchi A, et al. Differentierade glatta muskelceller genererar en subpopulation av inhemska vaskulära stamceller i adventitia reglerad av Klf4. Circ Res. (2017) 120:296-311. doi: 10.1161/CIRCRESAHA.116.309322
PubMed Abstrakt / CrossRef Fulltext / Google Scholar
40. Det är en av de mest populära och mest populära. Adventitial tertiär lymfoidorganklassificering vid Human ateroskleros. Cardiovasc Pathol. (2018) 32:8–14. doi: 10.1016/j.Karpat.2017.08.002
PubMed Abstrakt / CrossRef Fulltext / Google Scholar
41. Moos MP, John N, Grabner R, Nossmann S, Gunther B, Vollandt R, et al. Lamina adventitia är den huvudsakliga platsen för ackumulering av immunceller i standard chow-matade apolipoprotein E-bristfälliga möss. Arterioscler Tromb Vasc Biol. (2005) 25:2386–91. doi: 10.1161 / 01.FYRHJULING.0000187470.31662.fe
PubMed Abstrakt / CrossRef fulltext / Google Scholar
42. Mohanta SK, Yin C, Peng L, Srikakulapu P, Bontha V, Hu D, et al. Artär tertiära lymfoida organ bidrar till medfödda och adaptiva immunsvar vid avancerad mus ateroskleros. Circ Res. (2014) 114:1772-87. doi: 10.1161/CIRCRESAHA.114.301137
PubMed Abstrakt / CrossRef Fulltext / Google Scholar
43. Buettner M, Lochner M. utveckling och funktion av sekundära och tertiära lymfoida organ i tunntarmen och tjocktarmen. Främre Immunol. (2016) 7:342. doi: 10.3389 / fimmu.2016.00342
PubMed Abstrakt / CrossRef Fulltext / Google Scholar
45. Srikakulapu P, Hu D, Yin C, Mohanta SK, Bontha SV, Peng L, et al. Artär tertiära lymfoida organ kontrollerar flerskiktade territorialiserade ateroskleros B-cellsvar hos åldrade ApoE – / – möss. Arterioscler Tromb Vasc Biol. (2016) 36:1174–85. doi: 10.1161/ATVBAHA.115.306983
CrossRef Fulltext / Google Scholar
48. van de Pavert SA, Mebius RE. Nya insikter i utvecklingen av lymfoida vävnader. Nat Rev Immunol. (2010) 10:664–74. doi: 10.1038 / nri2832
CrossRef fulltext / Google Scholar
50. Barone F, Gardner DH, Nayar S, Steinthal N, Buckley CD, Luther SA. Stromala fibroblaster i tertiära lymfoida strukturer: ett nytt mål vid kronisk inflammation. Främre Immunol. (2016) 7:477. doi: 10.3389 / fimmu.2016.00477
PubMed Abstrakt / CrossRef Fulltext / Google Scholar
51. Scandella E, Bolinger B, Lattmann E, Miller S, Favre s, Littman DR, et al. Återställande av lymfoidorganintegritet genom interaktion mellan lymfoida vävnadsinducerande celler med stroma i t-cellzonen. Nat Immunol. (2008) 9:667–75. doi: 10.1038 / ni.1605
PubMed Abstrakt / CrossRef Fulltext / Google Scholar
52. Det finns många olika typer av produkter. Deficiency in lymphotoxin beta receptor protects from atherosclerosis in apoE-deficient mice. Circ Res. (2015) 116:e57–68. doi: 10.1161/CIRCRESAHA.116.305723
PubMed Abstract | CrossRef Full Text | Google Scholar
53. Guedj K, Khallou-Laschet J, Clement M, Morvan M, Gaston AT, Fornasa G, et al. M1 macrophages act as LTbetaR-independent lymphoid tissue inducer cells during atherosclerosis-related lymphoid neogenesis. Cardiovascular research. (2014) 101:434–43. doi: 10.1093/cvr/cvt263
PubMed Abstract | CrossRef Full Text | Google Scholar