Epoxidringöppningsreaktioner-SN1 vs. SN2, regioselektivitet och stereoselektivitet
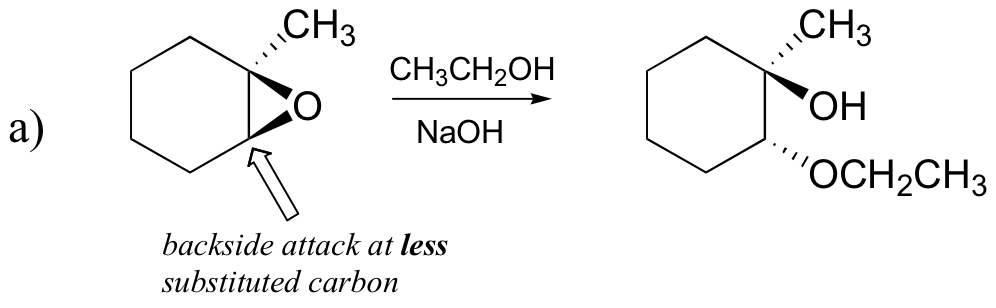
de icke – enzymatiska ringöppningsreaktionerna av epoxider ger en fin översikt över många av de begrepp vi redan har sett i detta kapitel. Ringöppningsreaktioner kan fortsätta med antingen SN2-eller SN1-mekanismer, beroende på epoxidens natur och på reaktionsbetingelserna. Om epoxiden är asymmetrisk varierar produktens struktur beroende på vilken mekanism som dominerar. När en asymmetrisk epoxid genomgår solvolys i basisk metanol, ringöppning sker med en SN2-mekanism, och det mindre substituerade kolet är platsen för nukleofil attack, vilket leder till vad vi kommer att hänvisa till som produkt B:

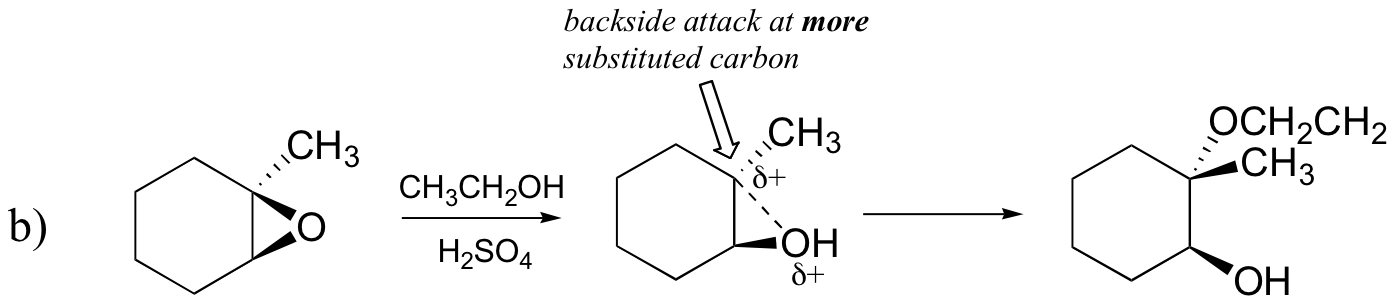
omvänt, när solvolys sker i sur metanol, sker reaktionen med en mekanism med väsentlig SN1-karaktär, och det mer substituerade kolet är attackstället. Som ett resultat dominerar produkt A.

dessa är båda bra exempel på regioselektiva reaktioner. I en regioselektiv reaktion är två (eller flera) olika konstitutionella isomerer möjliga som produkter, men en bildas företrädesvis (eller ibland uteslutande).
Låt oss undersöka det grundläggande SN2-fallet först. Den lämnande gruppen är en alkoxidanjon, eftersom det inte finns någon syra tillgänglig för att protonera syret före ringöppningen. En alkoxid är en dålig lämnande grupp, och därmed är det osannolikt att ringen öppnas utan ett ’tryck’ från nukleofilen.

nukleofilen i sig är potent: en deprotonerad, negativt laddad metoxidjon. När en nukleofil substitutionsreaktion involverar en dålig lämnande grupp och en kraftfull nukleofil, är det mycket troligt att fortsätta med en SN2-mekanism.
vad sägs om elektrofilen? Det finns två elektrofila kol i epoxiden, men det bästa målet för nukleofilen i en SN2-reaktion är det kol som är minst hindrat. Detta står för det observerade regiokemiska resultatet. Liksom i andra SN2-reaktioner sker nukleofil attack från baksidan, vilket resulterar i inversion vid det elektrofila kolet.
förmodligen är det bästa sättet att avbilda den syrakatalyserade epoxidringöppningsreaktionen som en hybrid eller korsning mellan en SN2-och SN1-mekanism. Först protoneras syret, vilket skapar en bra lämnande grupp (steg 1 nedan) . Sedan börjar kol-syrebindningen bryta (steg 2) och positiv laddning börjar byggas upp på det mer substituerade kolet (minns diskussionen från avsnitt 8.4 B om karbokföringsstabilitet).

till skillnad från i en SN1-reaktion attackerar nukleofilen det elektrofila kolet (steg 3) innan en fullständig karbokationsmellanprodukt har en chans att bildas.

Attack sker företrädesvis från baksidan (som i en SN2-reaktion) eftersom kol-syrebindningen fortfarande är i viss utsträckning på plats och syreblocken attackerar från framsidan. Lägg märke till, i alla fall, hur det regiokemiska resultatet skiljer sig från den baskatalyserade reaktionen: i den syrakatalyserade processen attackerar nukleofilen det mer substituerade kolet eftersom det är detta kol som har en större grad av positiv laddning.
övning 8.17:
förutsäga huvudprodukten(erna) av ringöppningsreaktionen som uppstår när epoxiden som visas nedan behandlas med:
a) etanol och en liten mängd natriumhydroxid
b) etanol och en liten mängd svavelsyra

Tips: Var noga med att överväga både regiokemi och stereokemi!
Khan academy videor

Ringöppning under sura förhållanden: