26 oktober 2020, av NCI-personal
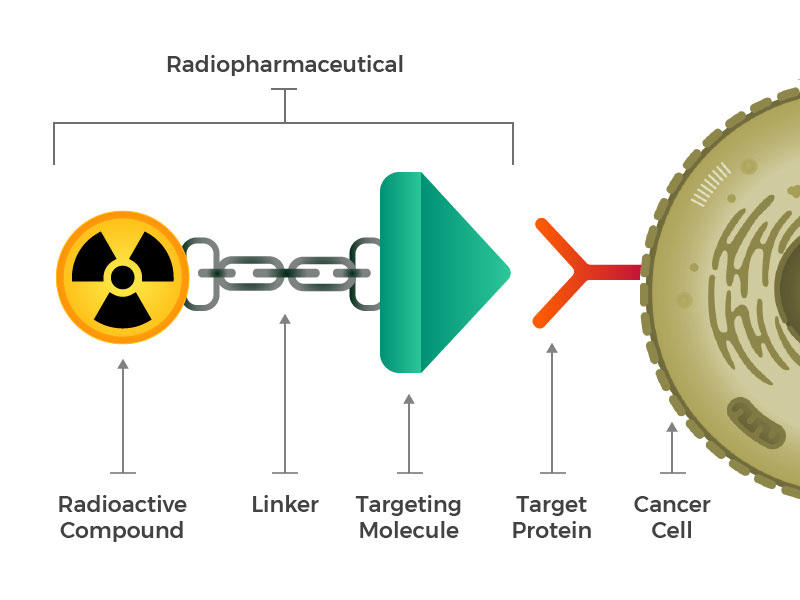
radiofarmaka består av en radioaktiv molekyl, en målmolekyl och en länkare som förenar de två.
de senaste två decennierna har medfört en stor förändring i hur många typer av cancer behandlas. Riktade terapier stänger av specifika proteiner i cancerceller som hjälper dem att växa, dela och sprida sig. Immunterapier stimulerar eller undertrycker kroppens immunsystem för att bekämpa cancer. Men länge använda behandlingar-kirurgi, kemoterapi och strålbehandling — förblir ryggraden i behandlingen för de flesta cancerformer.
strålterapi användes först för att behandla cancer för mer än 100 år sedan. Ungefär hälften av alla cancerpatienter får det fortfarande någon gång under behandlingen. Och tills nyligen fick de flesta strålterapi mycket som det var för 100 år sedan, genom att leverera strålar av strålning från utsidan av kroppen för att döda tumörer inuti kroppen.
även om det är effektivt kan extern strålning också orsaka säkerhetsskador. Även med modern strålterapiutrustning, ”måste du normal vävnad för att komma till en tumör”, säger Charles Kunos, MD, Ph.D., från NCI: s Cancer Therapy Evaluation Program (CTEP). De resulterande biverkningarna av strålbehandling beror på det behandlade området men kan inkludera smakförlust, hudförändringar, håravfall, diarre och sexuella problem.
nu utvecklar forskare en ny klass av läkemedel som kallas radiofarmaka, som levererar strålterapi direkt och specifikt till cancerceller. De senaste åren har en explosion av forskning och kliniska prövningar testat nya radioaktiva läkemedel.
dessa studier har föreslagit att inriktning på strålbehandling på cellulär nivå har potential att minska risken för både kort – och långsiktiga biverkningar av behandlingen samtidigt som även små avlagringar av cancerceller kan dödas i hela kroppen.
”jag tror att de kommer att omvandla strålningsonkologi under de kommande 10 till 15 åren”, säger Dr.Kunos.
att bygga på en naturlig affinitet
att leverera strålning direkt till celler är inte i sig ett nytt tillvägagångssätt. En sådan terapi, kallad radioaktivt jod, har använts för att behandla vissa typer av sköldkörtelcancer sedan 1940-talet. jod ackumuleras naturligt i sköldkörtelceller. En radioaktiv version av elementet kan produceras i labbet. När det tas in (som ett piller eller en vätska) ackumuleras det i och dödar cancerceller kvar efter sköldkörtelkirurgi.
en liknande naturlig affinitet utnyttjades senare för att utveckla läkemedel för att behandla cancer som har spridit sig till benen, såsom radium 223 diklorid (Xofigo), som godkändes 2013 för att behandla metastatisk prostatacancer. När cancerceller växer i benet får de benvävnaden de invaderar att bryta ner. Kroppen försöker sedan reparera denna skada genom att ersätta det benet—en process som kallas benomsättning.
det radioaktiva elementet radium ”ser ut som en kalciummolekyl, så det införlivas i områden i kroppen där benomsättningen är högst”, till exempel områden där cancer växer, förklarade Dr.Kunos. Radium kan sedan döda närliggande cancerceller.
dessa radioaktiva föreningar reser alla till cancerceller utan hjälp. Forskare undrade om det skulle vara möjligt att konstruera nya radioaktiva molekyler som specifikt riktar sig mot andra cancerformer.
de föreställde sig konstruerade radioaktiva läkemedel som består av tre huvudbyggstenar: en radioaktiv molekyl, en målinriktad molekyl (som känner igen och låser specifikt på cancerceller) och en länkare som förenar de två. Sådana föreningar kan injiceras, infunderas, inandas eller intas och sedan ta sig in i blodomloppet.
tanken att länka en cancermålande molekyl med en molekyl som dödar cancerceller är inte heller ny. Till exempel har flera läkemedel som kallas antikropp–läkemedelskonjugat, där en antikropp som binder till specifika cancerceller är kopplad till ett giftigt läkemedel, godkänts för behandling av cancer.
men ansträngningar för att skapa sådana droger har mött begränsad framgång, förklarade Dr. Kunos, eftersom det inte räcker att toxiner bringas nära en cancercell. Toxinerna måste tas inuti och stanna inne i cellerna tillräckligt länge för att orsaka skador. Många cancerceller har eller utvecklar mekanismer för att helt enkelt pumpa toxiner tillbaka innan det kan hända.
radioaktiva läkemedel fungerar också bäst när drogerna kan komma in i cellerna. Men det är inte nödvändigt för att de ska vara effektiva. När en radiofarmaceutisk har fastnat i en cancercell bryts den radioaktiva föreningen naturligt ner. Detta förfall frigör energi som skadar DNA i närliggande celler. Och när en cells DNA är irreparabelt skadad, dör den cellen. Cancerceller är särskilt känsliga för strålningsinducerad DNA-skada.
beroende på vilken typ av radioaktiv förening som används kan den resulterande energin tränga in i cellen bunden till radiofarmaceutiska såväl som omkring 10 till 30 celler som omger den cellen. Detta ökar antalet cancerceller som kan dödas med en enda radiofarmaceutisk molekyl.
i mitten av 2010-talet hade Food and Drug Administration (FDA) godkänt två radioaktiva läkemedel som riktar sig mot molekyler på vissa B-celler för att behandla vissa personer med icke-Hodgkin lymfom, en typ av blodcancer. Men dessa droger antogs aldrig allmänt. Få läkare som behandlade patienter med lymfom utbildades för att administrera dessa typer av radioaktiva föreningar. Och radiofarmaka inför konkurrens från nyare, icke-radioaktiva läkemedel.
spelväxlaren för fältet kom 2018, säger Jacek Capala, Ph. D., från NCI: s Strålningsforskningsprogram, när FDA godkände lutetium Lu 177-dotatate (Lutathera) för behandling av vissa cancerösa neuroendokrina tumörer (NETs) som påverkar matsmältningskanalen.
”detta visade att fasta tumörer också kan riktas på detta sätt”, med en radiofarmaceutisk byggd från början, sa han. I detta fall är målen vissa hormonreceptorer som finns i överflöd på ytan av NÄTCELLER.
Lutetium Lu 177-dotatate var bättre på att bromsa NETTOTILLVÄXTEN än något tidigare läkemedelstestat, förklarade Aman Chauhan, MD, vid University of Kentucky, som leder flera nya kliniska prövningar av läkemedlet. ”Det här var ett stort steg framåt för vårt område,” sa han.
anpassning av läkemedel från Bildföreningar
forskare designar och testar nu radioaktiva läkemedel för en rad olika cancerformer som melanom, lungcancer, kolorektal cancer och leukemi, säger Dr.Capala. Varje tumör som har en målinriktad molekyl på ytan av dess celler och en god blodtillförsel—tillräcklig för att leverera läkemedel—kan potentiellt behandlas med radioaktiva läkemedel, tillade Dr.Chauhan.
många av dessa nyare läkemedel är omkonstruerade versioner av befintliga föreningar som används för kärnbildning. Kärnbildningstester, såsom positronemissionstomografi (PET), använder ibland svagt radioaktiva föreningar kopplade till molekyler som binder till specifika mål på ytan av cancerceller. Specialiserade kameror kan sedan avslöja även små avlagringar av cancerceller, vilket hjälper till att mäta spridningen av cancer genom kroppen.
forskare har nu repurposed dessa inriktningsmolekyler för att bära mer potenta radioaktiva föreningar, eller isotoper, istället—de som kan döda cancerceller istället för att bara hjälpa till att visualisera dem.
prostatacancer har varit en tidig testplats för denna repurposing. Ett protein som kallas PSMA finns i stora mängder—och nästan uteslutande—på prostataceller. Genom att smälta en molekyl som binder till PSMA till en radioaktiv förening som används vid PET-avbildning, har forskare kunnat visualisera små avlagringar av prostatacancer som är för små för att detekteras genom konventionell avbildning.
flera radiofarmaceutiska behandlingar som riktar sig mot PSMA testas nu i kliniska prövningar.
de flesta prostatacancer är mycket känsliga för strålning, och extern strålning används ofta för att behandla sjukdomen, förklarade Frank Lin, MD, från NCI: s Centrum för cancerforskning, som leder en klinisk prövning av en PSMA-riktad radiofarmaceutisk vid NIH Clinical Center.
de flesta män som får strålning som sin första behandling kommer inte att uppleva en återkommande cancer. Men om de gör det sprider det sig ibland i hela kroppen, med många små avlagringar av cancerceller i många organ, förklarade han.
”när tumören har spridit sig så kan du inte riktigt göra extern strålning längre, eftersom extern strålning bara kan fokuseras på och behandla en liten del av din kropp åt gången”, säger Lin.
att ha ett radioaktivt läkemedel som riktar sig mot PSMA är ett bättre sätt att ge strålning i dessa fall, eftersom det kan infunderas direkt i blodflödet och cirkulera i stor utsträckning och fästa vid prostatacancerceller som har spridit sig i hela kroppen, förklarade han.
och en stor fördel med att ha bild-och behandlingsmolekyler som använder samma mål är att bildbehandling sedan kan ge läkare en förhandstitt på om behandlingen sannolikt kommer att fungera, tillade Dr.Lin.
till exempel, i Dr.lins försök måste män ha en PET-skanning med bildversionen av föreningen före behandling. Om bildföreningen finner sin väg till cancercellerna och detekteras på PET-skanningen, kan forskarna anta att motsvarande radiofarmaceutisk behandling kommer att träffa sitt mål.
”denna kompletterande utveckling av diagnostik hand i hand med läkemedelsbehandlingar gör detta område så mycket mer spännande”, säger Dr.Chauhan. ”På så sätt kan vi veta att vi levererar terapin direkt till tumörcellerna.”
flytta till kombinationsterapier
medan radioaktiva läkemedel har visat löfte i tidiga studier, är de också, som det är fallet med andra typer av cancerläkemedel, osannolikt att utplåna en tumör på egen hand.
till exempel, lutetium Lu 177-dotatate mer än fördubblat antalet personer som hade sina neuroendokrina tumörer krymper efter behandling, men det antalet var fortfarande blygsamt: cirka 17%, upp från 7% utan drogen, förklarade Dr.Chauhan.
” det finns fortfarande betydande utrymme för förbättringar,” sade han.
användning av radioaktiva läkemedel i kombination med andra terapier kan vara ett sätt att driva den förbättringen. Vissa forskare testar nu radioaktiva läkemedel i kombination med strålningssensibilisatorer—läkemedel som gör cancerceller ännu mer utsatta för strålning. Till exempel leder Dr.Chauhan en klinisk prövning av lutetium Lu 177-dotatat kombinerat med en strålningssensibiliserare som kallas triapin, vilket blockerar celler från att producera de föreningar som behövs för DNA-reparation efter strålningsinducerad skada.
i en annan studie testar Dr. Lin lutetium Lu 177-dotatate med en typ av läkemedel som kallas en PARP-hämmare. Dessa läkemedel, som redan är godkända för att behandla vissa typer av bröst -, äggstocks-och andra cancerformer, blockerar själva DNA-reparationsprocessen. ”Så strålningen skulle orsaka DNA-skadorna, och PARP-hämmaren skulle förhindra tumörcellerna från att läka sitt DNA efter strålningen,” förklarade han.
andra forskare kombinerar radioaktiva läkemedel med immunterapier för att försöka öka effektiviteten hos dessa läkemedel. ”Nya studier har visat att radioaktiva läkemedel kan göra tumörer mer mottagliga för immunterapi”, säger Dr.Capala.
många tumörer är” kalla ” tumörer, förklarade han, genom att immunceller inte känner igen dem eller inte fungerar ordentligt i mikromiljön runt tumörer, förklarade han.
men när strålning dödar cancerceller kan proteiner och DNA från dessa celler spillas in i blodomloppet för immunceller att se, vilket kan göra det möjligt för immuncellerna att känna igen och döda andra cancerceller i hela kroppen. Strålbehandling kan också göra tumörmikromiljön mer gästvänlig mot immunceller, tillade Dr. Capala.
tillsammans kan dessa effekter förvandla en kall tumör till en” het ” tumör: en som har ett överflöd av immunceller och kan vara mottaglig för immunterapi läkemedel. Vissa studier har försökt använda extern strålning för att skapa denna typ av svar.
” men det finns data som tyder på att det fungerar bättre om varje tumör, varje metastas, utsätts för strålning. Så radiofarmaceutisk terapi har en fördel där, genom att när den är i kroppen når den alla metastaser,” förklarade Dr.Capala.
det kan till och med vara meningsfullt att kombinera radioaktiva läkemedel med extern strålning, så länge noggrann behandlingsplanering kan säkerställa en säker Total strålningsdos, tillade Dr.Capala. ”Extern strålbehandling är mycket bra för att rikta in sig på stora tumörer, och då kan du kombinera den med radiofarmaceutisk terapi för att rikta metastaser”, sa han.
utmaningar och försiktighetsåtgärder
fältet för radioaktiva läkemedel är fortfarande i sina tidiga dagar. En utmaning som tillvägagångssättet måste övervinna innan det kan användas i större utsträckning är bristen på läkare utbildade för att administrera sådana läkemedel.
”antalet nukleärmedicinska läkare i USA är litet”, säger Dr.Lin, som har utbildning i både kärnmedicin och medicinsk onkologi. ”Och jag tror att vi bara tränar kanske 70 eller 80 nya människor om året.”
hittills har denna brist på arbetskraft hållit radiofarmaka från att leva upp till sin sanna potential som en personlig behandling, förklarade Dr.Capala. Den potentialen återspeglar det faktum att läkare, till skillnad från andra typer av cancerläkemedel, kan använda bildbehandling för att mäta exakt hur mycket av ett radioaktivt läkemedel som har nått en tumör, nästan i realtid, och justera dosen därefter.
men denna typ av dosplanering kräver tvärvetenskaplig expertis som inte är allmänt tillgänglig och har lämnat människor som använder radioaktiva läkemedel mer som ”radioaktiv kemoterapi” med en dos som passar alla, tillade han. ”Det betyder att många patienter inte får optimal behandling”, säger Dr.Capala.
långsiktiga säkerhetsstudier behövs också, tillade Dr. Chauhan. Personer som behandlas med extern strålbehandling kan uppleva några biverkningar, kallade sena effekter—som utveckling av andra cancerformer-månader eller år efter behandlingen. Även om forskning hittills inte har visat en hög grad av sena effekter från radiofarmaceutisk behandling,” det här är väldigt nya medel, och vi måste fortsätta att vara försiktiga och övervaka dem”, sa han.
Utjämningssamarbeten
eftersom dessa läkemedel är relativt nya, även med försöken pågår, ”vi skrapar bara ytan av läkemedelsutveckling för radiofarmaka”, säger Dr.Chauhan.
i 2019, för att ytterligare öka försöken av lovande nya radioaktiva läkemedel, lanserade NCI Radiofarmaceutiska Utvecklingsinitiativet (RDI) för att påskynda lovande nya läkemedel i klinisk testning.
en sak som NCI hoppas uppnå med RDI är att mäklare fler försök med kombinationer av läkemedel som produceras av olika läkemedelsföretag som kanske inte samarbetar annars, förklarade Dr.Kunos, som leder initiativet. Bekymmer om immateriella rättigheter och brist på förtroende kan stoppa sådana projekt innan de börjar, förklarade Dr.Kunos.
”dessa typer av samarbeten skulle inte nödvändigtvis hända om inte NCI var den ärliga mäklaren i mitten”, sa han. Just nu testar endast cirka 2% av tidiga fasförsök som stöds av NCI radiofarmaka, men med RDI kan detta växa exponentiellt under de kommande åren, tillade han.
”vi kommer inte att eliminera maskiner eller andra tekniker som vi använder i strålbehandling”, säger Dr.Kunos. ”Men med sin riktade natur tror vi att radioaktiva läkemedel kommer att förändra hur vi använder strålning.”