Kalmodulin
Detta är en videointroduktion till kalciumsignaleringsproteinet, kalmodulin, från en oorganisk kemists perspektiv!
Kalmodulin, eller CaM, är en polypeptid som är allestädes närvarande i alla eukaryota celler. Detta protein är känt som kalmodulin eftersom det är ett kalciummodulerat protein som spelar en viktig roll i processen för kalciumsignaltransduktion. Kalciumsignaltransduktion är den process genom vilken interaktionerna mellan kalciumjoner och många proteiner förmedlar kommunikation mellan celler. calmodulins funktion är därför nödvändig i alla eukaryota celler, och några av de uppgifter som det hjälper till att utföra är nervsignalering, skelettmuskelrörelse och minne. Genom att känna av kalciumjoner i miljön aktiverar kalmodulin och fungerar därefter som en mellanprodukt, initierar bindningen av viktiga proteiner såsom kinaser, vilket hjälper våra celler i grundläggande och sofistikerad funktion (”Kalmodulin”).
videon nedan visar den strukturella förändringen som sker inom CaM under kalciumbindning (PDB-koder 3CLN och 1cfd).
proteinet i sig är 148 aminosyror i längd med två globulära regioner innehållande 2 EF-handmotiv vardera, vilka är karakteristiska ställen för kalciummedierade polypeptider. När den aktiveras innehåller calmodulin 4 Ca2 + joner som drastiskt förändrar proteinets form. När kalmodulin binder med kalciumjonerna öppnar proteinet från sin apo-form till sin haloform och utsätter en alfa-helix som är känd som länkaren eller central tether-regionen. Myntade för sin flexibilitet är den centrala tether-regionen platsen för proteinet på vilket partnerproteiner binder och bidrar till kaskaden som är den sekundära meddelandet av kalcium. Baserat på dess struktur och dess behov av att kalciumjoner ska fungera måste kalmodulin kunna välja för kalciumjoner i cytoplasman, och interaktionerna mellan Jonen och liganderna i EF-handdomänerna stöder denna uppfattning om selektivitet (Bertini et. al., 635-638).
denna bild är en skildring av hur ett EF-hand-motiv liknar en hand. Banddiagrammet till vänster visar ett av de fyra karakteristiska helix-turn-helix EF-handmotiven av calmodulin. (PDB-kod 3CLN)
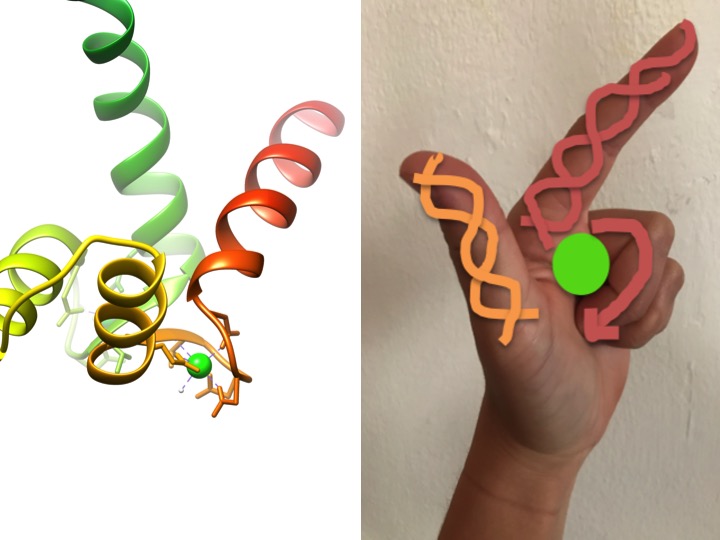
EF-handmotiv är mycket bevarade strukturella regioner av proteiner som är involverade i bindningen av kalcium. Dessa regioner är kända som” hand ” -motiv eftersom de liknar en hand som är gjord i form av en L, där metalljonen är belägen mitt i näven, alfa-spiralerna indikeras av det uppåtpekande pekfingret och inåtvänd tumme, och de böjda fingrarna representerar sväng-eller slingregionen. Detta visas i figuren ovan. I ett karakteristiskt EF-handmotiv binder aminosyror inklusive glutamater, asparaginer, asparaginsyror och glutaminsyror till Ca, såväl som vatten (Bertini et. al. 639). Den typiska EF – handdomänbindningssekvensen visas i figuren nedan.
denna tecknad illustrerar de samordnade aminosyrorna i en typisk EF – handdomän (den exakta aminosyrasammansättningen varierar!). Den streckade linjen representerar samordning av Ca till syre av en ryggrad karbonyl, medan fasta linjer indikerar samordning till sidokedjor eller vatten.
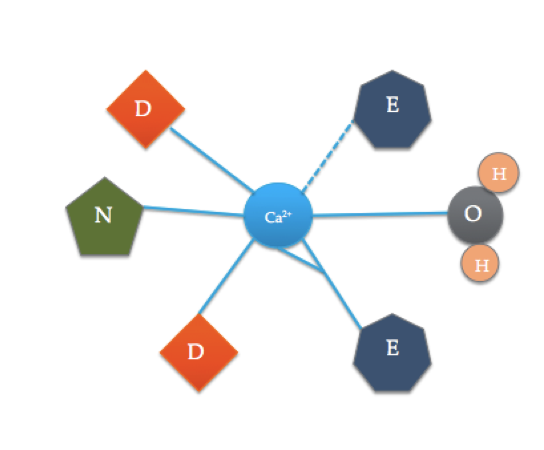
kalmodulinbindningsstället är något annorlunda än den mest typiska EF-handdomänen som visas ovan. De 6 liganderna av kalmodulin inkluderar sidokedjorna av tre asparaginsyror (D), 1 glutaminsyra (E) som bildar två koordinatkovalenta bindningar med jonen, 1 vattenmolekyl från lösning och 1 karbonylmolekyl från ryggraden. Bindningsstället för kalmodulin består av en Ca2+ Jon omgiven av 6 ligander medan de bildar 7 bindningar.
man kan märka att EF-motivet inom calmodulin innehåller många av samma ligander, bara på olika platser. Denna konformation kan ge en uppfattning om varför kalmodulin är selektiv för kalcium och hur Endast närvaron av en kalciumjon kan tillfredsställa bindningsstället som får proteinet att aktiveras. Detta är relaterat till termodynamiken för kalmodulin i cellen och hur den svarar på närvaron av kalciumjoner.
för att förstå termodynamiken som kopplar aktiveringen av kalmodulin måste man först förstå koncentrationen av joner som kalcium och magnesium i en eukaryot cell, inklusive den hos en människa. Koncentrationen av dessa joner måste regleras noggrant. Inom i cellen åtföljs kalciumsignalering av en tillfällig ökning av koncentrationen av kalciumjoner, vilket avkänns av proteiner såsom kalmodulin (Bertini et. al., 636). Denna kalciumöverskott kan bero på intracellulära G-proteiner som inducerar det grova och släta retikulumet för att frigöra kalcium, eller kalciumjonerna kan föras in från det extracellulära utrymmet. När det gäller kalmodulin svarar det vanligtvis på att kalcium förs in i cellen från utsidan, vilket inträffar under processer som nervsignalering (Bertini et. al. 637). Innan koncentrationen av kalcium tillfälligt höjs är koncentrationen i cellen vanligtvis mellan 10-100 nm, medan koncentrationen under den korta tillströmningen av joner ökar till 1 000-100 000 nm. Förändringen i koncentration får kalmodulin att känna av kalciumjonerna, binda dem och initiera ytterligare signaltransduktion (Bertini et. al., 635).
hur binder kalmodulin slutligen kalciumjoner och inte till exempel magnesiumjoner? Mg2 + joner är faktiskt ganska lik kalciumjoner: de skulle engagera sig i elektrostatiska interaktioner snarare än kovalenta, och de anses vara hårda atomer. Anledningen till att kalmodulin verkar gynna kalciumjoner snarare än magnesiumjoner är relaterad till bindningskonstanterna för varje jon. Kalmodulin kan existera medan det är bundet till andra joner, såsom magnesium, men om det finns en högre koncentration av kalcium, kommer kalciumjonerna omedelbart att konkurrera ut magnesiumjonerna för att uppta kalciumbindningsställen. Detta beror på att bindningskonstanten för CaM och Ca2+ (Ka) är större än den för CaM och Mg2+, som visas i Figur 7. Detta indikerar att när kalmodulin binds till kalciumjoner skulle det producera fler produkter. Man måste överväga alla dessa tankar med tanke på att denna process sker otaliga gånger per sekund, och omsättningen av detta protein förändras för att svara på den ständigt modulerade kalciumkoncentrationen i cellen.
varför är kalmodulinbindning med kalciumjoner mer gynnsam än med andra metaller? Det kan bero på jonernas storlek i förhållande till det steriska hindret som induceras av liganderna. Bindningsstället kännetecknas av 6 ligander som gör 7 koordinatbindningar. Eftersom kalciumjoner är större än magnesiumjoner, vilket visas i Figur 8, är det möjligt att kalcium gynnas eftersom det ökar ligandernas avstånd från varandra, vilket minskar steriska interaktioner mellan liganderna. Själva strukturen hos proteinet i sig kan också utgöra en orsak till selektiviteten hos kalciumjoner. Sammantaget är det känt att på grund av termodynamik baserad på varierande cellkoncentration av kalciumjoner, kommer kalmodulin att känna ökningen av joner, binda dem och hjälpa till att utföra sin funktion.
CaM + Ca2+ <–> Ca2+CaM (KCaM-Ca)
CaM + Mg2+ <–> Mg2+CaM (KCaM-Mg)
Mg2+-CaM + Ca2+ <–> Ca2+CaM + MG2+
eftersom kcam-ca > Kcam-mg
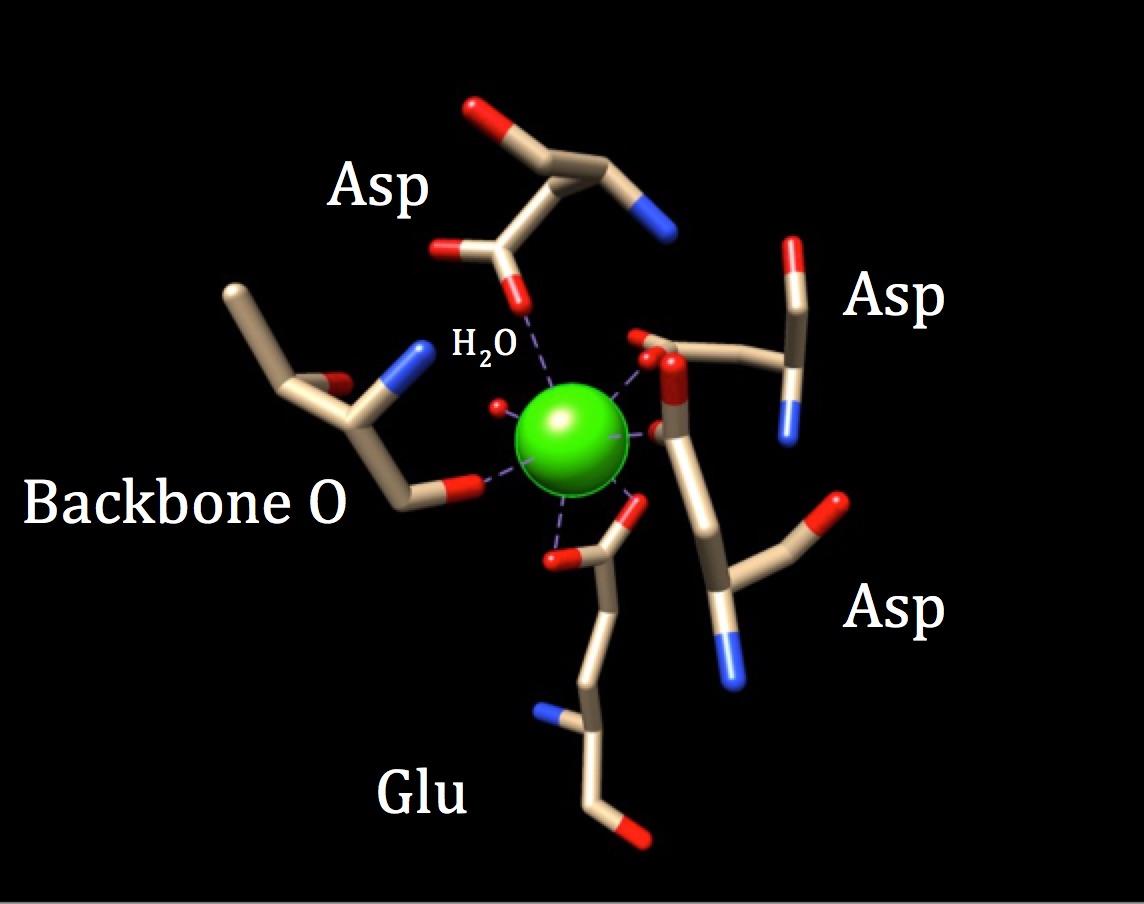
i en vidare diskussion om kemin på bindningsstället för Kalmodulin bör Koordinationsgeometrin undersökas. Eftersom kalciumjonen interagerar med sju givaratomer är systemet känt som ett heptadentatsystem. Eftersom kalmodulin är omgiven av sex ligander, skulle man anta en oktaedrisk koordinationsgeometri. Men eftersom en av liganderna interagerar på ett bidentat sätt med jonen—vilket betyder att den har två koordinatkovalenta bindningar som kommer från olika atomer i en aminosyra—tar koordinationskomplexet en förvrängd oktaedrisk form. Den specifika samordningen beskrivs i figuren nedan.
koordinationsgeometrin för calmodulins kalciumbindningsställe. Den centrala kalciummetalljonen är omgiven av tre asparaginer (Asp), ett ryggradssyre, en gluatminsyra (Glu) och en vattenmolekyl. (PDB-kod 3CLN)
vi kan också hänvisa till teorin om kelateffekten för att bättre förstå kalmodulin förmåga att binda till metalljoner med hög affinitet. En kelator är en atom som kan binda med mer än en givaratom. Polydentatbindning är relaterad till kelateffekt, som säger att när en ligand binder med många givargrupper (poly) är de kovalenta kovalenta bindningarna mycket starkare eller mer tätt hållna. Denna teori backas upp av termodynamik, specifikt att polydentatbindning ökar entropin i ett system, vilket gör det mer positivt (mer störning), vilket är termodynamiskt gynnsamt. Att tillämpa denna teori på kalmodulin hjälper till att förklara inte bara vikten av polydendatbindningen inom platserna själva, utan också behovet av att proteinet binder 4 olika kalciumjoner för att aktivera dess funktion. Genom att väsentligen kräva bindning av fyra Ca2 + – joner inom platserna uppmuntrar systemet en ökning av entropi genom att införa fler substrat/reaktanter för att bilda ett större antal produkter. Detta inträffar på grund av det högre antalet bindningar inom ligandinteraktionerna för varje bindningsplats. Sammantaget stöds bindningen av kalciumjonen i polypeptidens ställen av kelateffektteorin och belyser kalmodulins effektivitet vid bindning av kalcium.
EF – handmotiv har en viss struktur baserad på det faktum att kalcium är den centrala metallen. Detta gäller också för kalmodulinbindningsställena. Ca2 + – Jonen binder med liknande atomer i strukturerna för vissa aminosyror baserat på en teori som kallas hård/mjuk Syrabasteori. Denna teori separerar metaller och ligander i två kategorier baserat på polariserbarheten och deras laddnings-radieförhållande. Hårda syror och baser är mindre joner som har ett större förhållande mellan laddning och storlek, och detta leder dem att interagera på elektrostatiska sätt (vilket betyder attraktioner mellan + och – laddningar), medan mjuka syror och baser är större i storlek och därför har ett mindre förhållande mellan laddning och radie, vilket leder dem att göra bindningar med kovalent karaktär. Uttrycket” som binder med liknande ” hänvisar till det faktum att hårda syror och baser tenderar att interagera med andra hårda atomer, och detsamma gäller för mjuka syror och baser. Ca2 + karakteriseras som en hård syra eftersom den, även om den har en stor radie, interagerar med ligander på ett mest elektrostatiskt sätt. När man tittar på kalciumbindningsstället för kalmodulin kan man se att kalciumjonen binder till syreatomer av de 3 asparaginsyrorna, glutaminsyra, vatten och ryggradskarbonyl. Denna bindning är i linje med” like binder med like ” eftersom vatten och aminosyrorna ligander, glutaminsyra och asparaginsyra, binder genom syregivare som karakteriseras som hårda baser. Figur 10 återbesöker bindningsställena för kalmodulin samtidigt som de visar de negativa sidokedjorna hos aminosyrorna som skulle interagera med kalciumjonerna betecknade i blått.
när det gäller givaratomerna i de bundna liganderna och deras förmåga att donera elektronpar till koordinationskomplexet, förklarar den spektrokemiska serien hur atomerna interagerar med den centrala metallen. När det gäller det kalciumbindande stället anses oxygenerna som interagerar med Ca2+ – Jonen alla som givare av hCG, eftersom donatoroxygenerna har 2 eller flera elektronpar. Kategorierna av de spektrokemiska seiresna som specificerar elektrontillgänglighet och donation har konsekvenser för spinnbeteckning (låg eller hög), som anger hur d-elektroner fyller i sina orbitaler och deltastorlek mellan metallens d-orbitaler, men detta gör ingen skillnad för kalcium eftersom kalciums d-orbitaler är oupptagna på grund av frånvaro av valens d-elektroner. Detta gör D-orbitalerna väsentligen försumbara i de flesta samtal om proteinet. Ett undantag är relaterat till att överväga labiliteten hos kalciumjonen i systemet.
bristen på elektroner i Ca: s d-orbitaler ger noll ligandfältstabiliseringsenergi och förklarar kalciumjonens höga labilitet. Labilitet avser den hastighet med vilken ligander kan ersättas i koordinationskomplex och beskriver därför kinetiken hos ett system. Atomer är labila om de snabbt byter ligander. På grund av dess relevanta funktion i alla eukaryota celler förväntas kalmodulin binda och frigöra kalciumjoner miljoner gånger per sekund för att skicka och ta emot meddelanden från omgivande celler genom överföring av kalciumjoner. När det gäller calmodulins förmåga att binda och släppa Ca2+ snabbt är det viktigt att överväga beläggningen av valens d-elektronorbitaler. Som sagt har kalcium tomma Valens d-orbitaler. Dessa obebodda orbitaler kan ge upphov till en förklaring till en Ca2+ Jon labilitet. Eftersom alla kalciumjonens d-orbitaler är tomma, har den en ligandfältstabiliseringsenergi (LFSE) på 0. Detta indikerar att kalcium är instabilt när man överväger LFSE på grund av det faktum att stabila molekyler vanligtvis har ett negativt värde för LFSE. Instabilitet i detta fall översätts till en vilja att reagera snabbt och gå vidare och av komplex, vilket stöder påståendet att Ca2+ – joner uppmuntrar snabba reaktioner och kan karakteriseras som labila. Även om detta verkar vara kontraintuitivt för diskussionen med kelateffekt, är det underförstått att dessa två teorier inte motsäger varandra. Stabiliteten hos de tätt hållna koordinationsbindningarna som föreslås av kelateffekten uppmuntrar kalmodulin att förbli stabil tillräckligt länge för att binda tilläggsproteiner. När det är klart och koncentrationen av kalcium återgår till det normala är det effektivt att avlägsna kalciumjonernas plats.
Kalmodulin, baserat på dess struktur och sammansättningen av dess vitala bindningsställe, spelar en integrerad del av otaliga processer som utförs av eukaryota celler. Genom att acceptera och binda kalciumjoner i signaltransduktion fungerar kalmodulin som en central komponent i grundläggande och högnivåfunktion i organismer som människor. Genom att tillämpa bioinorganisk teori och förstå en förståelse för den noggrant övervakade miljön hos en eukaryot cell kan man korrekt förstå kalmodulin förmåga att välja för kalciumjoner och uppmuntra ytterligare funktion som involverar mer än 100 partnerproteiner.