electrólitos iónicos
água e outras moléculas polares são atraídos para íons, tal como demonstrado na figura \(\PageIndex{2}\). A atração eletrostática entre um íon e uma molécula com um dipolo é chamada de atração íon-dipolo. Estas atrações desempenham um papel importante na dissolução de compostos iônicos na água.
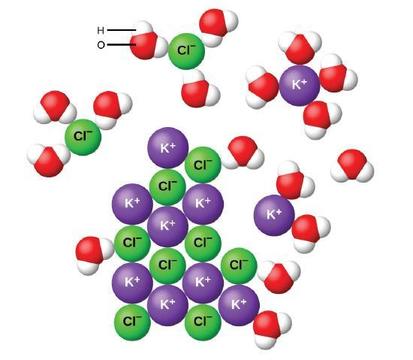
quando compostos iónicos se dissolvem em água, os iões no sólido separam-se e dispersam-se uniformemente por toda a solução porque as moléculas de água rodeiam e solvam os iões, reduzindo as fortes forças electrostáticas entre eles. Este processo representa uma mudança física conhecida como dissociação. Sob a maioria das condições, compostos iônicos dissociam-se quase completamente quando dissolvidos, e assim eles são classificados como eletrólitos fortes.
vamos considerar o que acontece no nível microscópico quando adicionamos KCL sólido à água. As forças de íon-dipolo atraem a extremidade positiva (hidrogênio) das moléculas de água polar para os íons de cloreto negativos na superfície do sólido, e eles atraem o negativo (oxigênio) termina para os íons de potássio positivos. As moléculas de água penetram entre K+ e Cl− iões individuais e rodeiam-nos, reduzindo as fortes forças interiónicas que ligam os iões em conjunto e deixando-os moverem-se para a solução como íons solvados, como mostra a figura. A redução da atração eletrostática permite o movimento independente de cada íon hidratado em uma solução diluída, resultando em um aumento no transtorno do sistema como os íons mudam de suas posições fixas e ordenadas no cristal para Estados móveis e muito mais desordenados em solução. Esta desordem aumentada é responsável pela dissolução de muitos compostos iônicos, incluindo KCl, que se dissolvem com a absorção de calor.
Em outros casos, as atrações eletrostáticas entre os íons em um cristal são tão grandes, ou o íon-dipolo forças atrativas entre os íons e as moléculas de água são tão fracas, que o aumento na desordem não pode compensar a energia necessária para separar os íons, e o cristal é insolúvel. Tal é o caso de compostos como carbonato de cálcio (calcário), fosfato de cálcio (o componente inorgânico do osso) e óxido de ferro (ferrugem).