Vitamina E Tratamento para Pacientes com esteato-hepatite Não –
Jhonathan Ferney Vélez M. (1), Gustavo Amador Crespo H. (1), Juan Carlos Restrepo G. MD. Esp, MSc, PhD. (2)
(1) estudante de Medicina da Faculdade de Medicina da Universidade de Antioquia, em Medellín, Colômbia.
(2) Professor Associado do Departamento de Medicina Interna e do grupo de Gastrohepatologia da Universidade de Antioquia e hepatologista do Hospital Pablo Tobón Uribe em Medellín, Colômbia. [email protected]
Recebido: 12-02-14 Aceito: 05-11-14
Resumo
Não-esteato-hepatite (NASH) é caracterizada histologicamente pela balonismo de hepatócitos, inflamação lobular e esteatose. Se este diagnóstico é suspeito, é importante excluir outras causas de danos hepáticos, especialmente o consumo excessivo de álcool. No entanto, até à data, uma biópsia é o único método disponível para confirmar o diagnóstico. A vitamina E deve ser considerada uma terapêutica de primeira linha para o tratamento desta doença, uma vez que vários estudos clínicos demonstraram que uma dose de 800 UI/dia melhora a histologia de adultos não diabéticos que sofrem de NASH, mesmo quando não há impacto significativo na fibrose. Estes resultados foram confirmados por biópsias. Apesar dos benefícios comprovados do uso desta droga, é importante estar ciente de que o seu uso não pode substituir as mudanças na dieta e no exercício, mas deve ser visto como um complemento a estas medidas.
palavras-chave
esteatohepatite não-alcoólica, vitamina E, stress oxidativo.
introdução
NASH é caracterizado histologicamente pelo balonismo de hepatócitos, inflamação lobular e esteatose (1, 2). Atualmente, NASH só pode ser diagnosticado através de uma biópsia do fígado, que é o padrão-ouro diagnóstico. Também fornece informações sobre a presença e o grau de inflamação, necrose e fibrose que são importantes para estabelecer o prognóstico do paciente (2-5). As diferenças entre NASH e esteatohepatite alcoólica são microscopicamente pequenas, o que dificulta histologicamente a diferenciação entre elas. Por esta razão, é importante obter informações do paciente sobre seus hábitos de bebida (4).
NASH faz parte de uma entidade muito mais ampla chamada NAFLD (doença hepática gorda não-alcoólica) que inclui os estágios iniciais da esteatose hepática: esteatose sem inflamação, e esteatose com inflamação ligeira. Em última análise, o NAFLD se desenvolve na condição inflamatória característica de NASH que progride para a fibrose e, finalmente, cirrose (1, 2, 5). Ainda não é completamente claro que os indivíduos progridem da esteatose simples ao estado inflamatório. As interacções entre susceptibilidade genética, distúrbios metabólicos e stress oxidativo são os factores mais importantes (6, 7).
NAFLD é a doença hepática mais prevalente em todo o Mundo (2, 4, 6). Estima-se que a prevalência do NAFLD seja de 20% a 30%, e pensa-se que a prevalência de NASH seja de 2% a 3% na população geral do mundo ocidental (8).
devido às suas qualidades antioxidantes, A vitamina E foi recomendada nas actuais directrizes americanas para o tratamento de NASH. “A vitamina E (α-tocoferol) administrada na dose diária de 800 UI / dia melhora a histologia hepática em adultos não diabéticos com o NASH provado por biopsia” isso não obvia a importância da intervenção no estilo de vida do paciente e dieta como parte do tratamento básico para pacientes com NASH (9, 10). Neste artigo revisamos a fisiopatologia de NASH com ênfase no papel da vitamina E no tratamento de pacientes com esta doença.
patofisiologia
embora a patogênese de NASH ainda não seja completamente clara, a melhor hipótese aceite proposta até à data para explicar os eventos que levaram à esteatose e, subsequentemente, à esteatohepatite é a teoria dos dois hit. O primeiro impacto no início desta doença é a sobrecarga de gordura (11, 12). Um estilo de vida sedentário, os factores genéticos e o aumento da ingestão de calorias tornam os indivíduos mais susceptíveis ao desenvolvimento de resistência à insulina e hiperinsulinemia, o que leva a um aumento da síntese lipídica hepática e à libertação de ácidos gordos livres do tecido adiposo. Se o fígado é mantido neste estado, torna-se incapaz de metabolizar todos os ácidos gordos que produz e que são removidos da circulação. Esta condição eventualmente leva ao segundo hit que é esteatose hepática e estresse oxidativo (4, 5, 13).
stress oxidativo é um desequilíbrio que favorece os pró-oxidantes sobre os antioxidantes (3). Durante a esteatose hepática, os hepatócitos entram num estado hipermetabólico que conduz ao aumento da produção de radicais livres nas organelas celulares (13). Quantidades crescentes de espécies reativas de oxigênio (ROS) em hepatócitos levam à peroxidação lipídica, que é uma reação que fornece um fornecimento contínuo de radicais livres adicionais com efeitos potencialmente devastadores (14, 15).
um antioxidante é a vitamina E (tocoferol), que reage com peróxidos lipídicos para os Reduzir para ácidos gordos. Eles formam o radical relativamente estável tocoferoxil que persiste o tempo suficiente para passar para o tocoferol por meio de uma reação com vitamina C na superfície celular (12). Devido a esta característica, a vitamina E tem sido considerada para uso como um tratamento para pacientes com NASH (13, 16).
manifestações e diagnóstico
NAFLD é uma síndrome comum que varia de esteatose simples a esteatohepatite (NASH) com fibrose subsequente e cirrose (5). Embora no diagnóstico a maioria dos pacientes são assintomáticos, alguns pacientes, especialmente crianças, podem queixar-se de fadiga e desconforto. O desconforto no quadrante superior direito do abdómen, a suspeita devido ao aumento dos níveis de aminotransferases e uma ecografia abdominal com uma doença hepática brilhante são todos os sinais desta doença. Obesidade, diabetes e dislipidemia também deve ser levado em conta durante a avaliação de condições que podem estar associadas com NAFLD e NASH (5, 17).
durante a avaliação de diagnóstico devem ser excluídas outras causas comuns de doença hepática, mas, em última análise, uma biópsia hepática é o único método disponível para confirmar o diagnóstico. Também é importante para definir o prognóstico do paciente (Tabela 1) (3, 4). Apesar de seu grande valor clínico, uma biópsia é cara e leva a um ligeiro aumento de morbilidade e, em raras ocasiões, resulta em mortalidade. Esta ferramenta só deve ser considerada para os pacientes, para os quais a presença de não-esteatose hepática é suspeita de que estão em alto risco de esteato-hepatite e fibrose avançada (obesidade, diabetes tipo II mellitus, dislipidemia e síndrome metabólica) e, em casos de diagnóstico incerto (3, 9).

papel da vitamina E no tratamento da esteatohepatite não-alcoólica
actualmente não existe um tratamento eficaz para NASH. No entanto, tendo em conta o importante papel da vitamina E como factor antioxidante, foram realizados vários ensaios clínicos para demonstrar os seus benefícios na evolução clínica e histopatológica desta doença (Tabela 2).
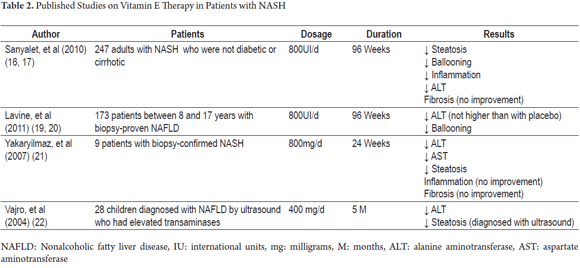
entre estes está o ensaio PIVENS (pioglitazona versus vitamina E versus placebo para o tratamento de doentes não diabéticos com esteatohepatite não alcoólica). Este foi um estudo multicêntrico, em dupla ocultação, controlado com placebo, no qual a melhoria histológica foi avaliada em 247 doentes não diabéticos e não cirróticos com NASH. Os doentes foram distribuídos aleatoriamente para receberem uma dose diária de pioglitazona (80 doentes), vitamina E (84 doentes) ou um placebo (83 doentes) durante noventa e seis semanas (18). As doses diárias foram 30mg para a pioglitazona e 800U para a vitamina E. Este estudo mostrou que 43% dos pacientes que receberam a vitamina E (P = 0,001) melhorou vs. 34% dos que receberam pioglitazona (P = 0,04) e 19% dos que receberam placebos. A diferença nas taxas de melhoria entre a pioglitazona e o placebos não foi estatisticamente significativa, enquanto que a diferença entre as taxas de melhoria da vitamina E e do placebos foi. No entanto, ambos os fármacos estiveram associados à melhoria dos níveis de aminotransferase, redução da esteatose e inflamação lobular, mas nenhum resultou numa melhoria na fibrose. O mesmo estudo demonstrou que, após o tratamento com vitamina E, os níveis de aminotransferase em suspensão aumentaram, indicando que pode ser necessária uma administração indefinida do tratamento. Além disso, não foram detectadas diferenças significativas entre os efeitos adversos da vitamina E e os efeitos adversos dos placebos (19).
uma reavaliação do ensaio PIVENS por Hoofnagle et al. centrou-se na resposta da ALT sérica em doentes que receberam vitamina E ou placebos e na associação desta resposta com as alterações clínicas, histológicas e interacções iniciais com alterações no peso corporal. Verificou-se que as alterações na ALT eram mais frequentes entre os que receberam vitamina E (48%) do que nos que receberam placebos (16%; p <0, 001). Entre o grupo a receber vitamina E, as respostas ALT foram associadas à diminuição da actividade da doença hepática gorda não-alcoólica (NAFLD), mas não houve melhoria na fibrose após o final do tratamento às 96 semanas. Os níveis de ALT aumentaram no grupo da vitamina E após o fim da administração, mas não aumentaram no grupo placebo após o fim da administração. Ambos os grupos de tratamento tinham níveis de ALT quase idênticos na semana 120. Estes resultados são semelhantes aos mostrados na coorte completa da publicação principal do ensaio PIVENS. Além disso, os resultados mostraram que a perda de peso (2 kg ou mais) também está associada com ALT resposta, com a melhoria da NAFLD (<0.001) e melhoria da fibrose (p <0.02), mas a vitamina E, têm maiores efeitos na NAFLD independente das alterações no peso corporal. Por último, deve-se notar que os efeitos da vitamina E e da perda de peso na resposta ALT e histologia são independentes, o que significa que mesmo os doentes que perdem peso beneficiariam da terapêutica com vitamina E (20).
o ensaio tónico (Treatment of nonalcoholic fatty liver disease in children) foi outro estudo multicêntrico, em dupla ocultação, controlado com placebo. Incluiu 173 pacientes entre os oito e os dezessete anos de idade. Os doentes foram distribuídos aleatoriamente para receber vitamina E (58 doentes), metformina (57 doentes) ou placebos (58 doentes) durante 96 semanas. As doses foram de 400 UI duas vezes por dia para a vitamina E e de 500 mg duas vezes por dia para a metformina (21). Nenhum dos fármacos foi superior ao dos placebos para alcançar reduções sustentadas de pelo menos 50% nos níveis basais de ALT ou níveis contínuos de ALT de 40 U/L ou menos. Foram efectuadas medições de 12 em 12 semanas, desde a semana 48 até à semana 96. Este estudo também concluiu que a resolução de NASH foi significativamente mais elevada no grupo de doentes tratados com vitamina e do que no grupo placebo. Este resultado foi atribuído à diminuição significativa do Balonismo hepatocelular que foi encontrada em doentes tratados com vitamina E. Isto é semelhante aos resultados de PIVENS, embora o ensaio tónico não tenha considerado a diminuição do Balonismo hepatocelular como um resultado primário devido às diferenças histopatológicas entre a NALFD em doentes pediátricos e adultos. O estudo tónico não encontrou melhoria na fibrose (22).
antes destes dois grandes estudos, haviam sido realizados outros estudos mais pequenos, com resultados com grandes diferenças nos resultados primários avaliados. Para além de populações muito mais pequenas, estes estudos tiveram menos tempo de monitorização e alguns deles não foram controlados com grupos com placebo.
a 2007 study by Yakaryilmaz et al. analisei o efeito da vitamina E em nove pacientes cujos diagnósticos de NASH tinham sido verificados por biopsia. O estudo avaliou o efeito da vitamina E no receptor gama activado pelo proliferador de peroxissoma (PPARG) e na resistência à insulina. Os doentes receberam 800 mg de vitamina E por dia durante 24 semanas. Antes do início do tratamento, os fígados dos doentes foram avaliados bioquímicamente e histologicamente. Estas avaliações foram repetidas após o fim do tratamento. No final das 24 semanas, foram encontradas diminuições estatisticamente significativas de AST, ALT e esteatose, mas não foram encontradas alterações histológicas no nível de inflamação e fibrose. Nenhum doente teve efeitos adversos nesta dosagem de vitamina E (23).
Vajro, et al. (2004) conduziu um estudo de um grupo de 28 crianças com disfunção hepática relacionada com a obesidade. Os doentes foram divididos em dois grupos. A idade média do grupo um era de 9,88 (+/- 3,97) anos, e do grupo dois era de 10,7 (+/- 3,45). Os doentes foram avaliados para determinar se existiam efeitos benéficos do tratamento com vitamina E na perda de peso, níveis de transaminases e esteatose medidos por ultra-som. Todas as crianças incluídas neste estudo apresentavam hipertransaminasemia crónica (níveis de AST ou ALT 1, 5 vezes acima do valor normal durante mais de 6 meses) e sinais de esteatose em ultra-sons. O estudo teve um desenho único cego, no qual os doentes foram aleatorizados num dos dois grupos: Grupo 1 (placebo mais dieta) e Grupo 2 (dieta de vitamina E+). Mais tarde, cada grupo foi subdividido dependendo da conformidade do paciente com o tratamento. O grupo 1 foi dividido em subgrupo 1A para os que cumpriram a dieta e o subgrupo 1B para os que não cumpriram. O grupo 2 foi dividido em subgrupo 2A para os que tinham cumprido a terapêutica com vitamina E E E o subgrupo 2B para os que não tinham cumprido a terapêutica com vitamina E. O subgrupo 2A foi ainda dividido em subgrupo 2A1 para aqueles que não cumpriram a dieta e o subgrupo 2A2 para aqueles que cumpriram a dieta. O estudo concluiu que a dose de 400 mg/dia de vitamina e produziu reduções significativas nos valores de ALT para os doentes do subgrupo 2A que se aproximaram da normalização independentemente de quaisquer alterações no peso. Por outro lado, os doentes que atingiram níveis séricos elevados de vitamina E e que também perderam peso atingiram a normalização da ALT e a remissão da esteatose. Além disso, uma comparação entre o Subgrupo 1A, que cumpriu apenas com dieta e Subgrupo 2A1 que só cumprido com vitamina E terapia verificou que ambos os grupos de pacientes apresentaram diminuição dos níveis de ALT em dois meses de monitoramento, mas que houve uma redução mais acentuada no Subgrupo 1A (cumpridos somente com dieta) do que no Subgrupo 2A1 (só cumprido com vitamina E) em cinco meses de acompanhamento. Todos os sinais de esteatose desapareceram das imagens de ultra-sons do subgrupo 2A2 que perderam peso durante o tratamento com 400 mg de vitamina E. Estes resultados destacam a importância de promover a alimentação saudável como uma das principais intervenções de tratamento para pacientes com NASH, mas devemos também notar que muitos pacientes não cumprem os regimes alimentares que levam ao fracasso da intervenção. Isto sublinha a importância da utilização de antioxidantes como a vitamina E como uma boa terapêutica alternativa para estes doentes (24).
um estudo-piloto realizado por Kugelmas, et al. (2003) evaluated the effects of Step 1 of the American Heart Association diet combined with increased aerobic exercise with and without daily administration of vitamina E on the profiles of cytokines (TNF alpha, IL-8, IL -6) and levels of liver enzymes in 16 patients between 18 and 65 years of age with biopsia proved NASH. Este foi um estudo em dupla ocultação no qual os doentes foram distribuídos aleatoriamente para receberem 800 UI de vitamina E por dia. Os doentes que não receberam vitamina E receberam placebos. O teste foi realizado durante um período de 12 semanas. Os valores da citoquina não diminuíram significativamente com a perda de peso com ou sem a administração de vitamina E durante o estudo. As alterações no estilo de vida foram associadas a melhorias nas enzimas hepáticas e no colesterol plasmático em doentes com NASH, enquanto que a dose de vitamina E utilizada neste estudo não demonstrou qualquer benefício adicional. Este resultado pode ser devido ao pequeno tamanho da amostra, O curto período de acompanhamento, ou a dosagem de vitamina E utilizada (25, 26).
Uma revisão publicada em novembro de 2013 actualmente de cerca de opções disponíveis para o tratamento de pacientes com NASH reconhecida a recomendação atual para o uso da vitamina E como terapia de primeira linha em pacientes com NASH confirmado através de biópsia que não cirróticos e que não têm diabetes, mas também destacou o fato de que esta terapia tem mostrado apenas um benefício significativo em menos de metade dos doentes. Por esta razão, a revisão concluiu que as futuras estratégias de tratamento devem basear-se nas vias patogénicas da doença se algum dia for desenvolvido um tratamento eficaz para doentes com NASH (27).
Ji H-F et al. realizou uma meta-análise para avaliar o efeito da vitamina E na diminuição das aminotransferases em doentes com NAFLD, NASH e hepatite C crónica (CHC). Os quatro estudos que analisaram incluíram pacientes com NASH que receberam suplementos de vitamina E. Os estudos incluíram os ensaios tónicos e PIVENS. Eles descobriram que a vitamina E poderia otimizar os níveis de AST e ALT nestes pacientes. No entanto, deve notar-se que esta meta-análise foi limitada pela impossibilidade de excluir a incapacidade para excluir os efeitos de intervenções envolvendo mudanças de estilo de vida, o exercício e o uso de outros antioxidantes e de uma incapacidade para excluir os efeitos de outros fatores de risco para as doenças crônicas do fígado, tais como o álcool e uso de drogas, somado a isso, a a heterogeneidade dos estudos deve ser levado em conta, pois limita a análise geral, bem como ter menos de especificidade para os níveis de transaminases de biópsias tirada no momento do diagnóstico e avaliação da doença hepática (28).
Embora entre os principais estudos para avaliar o efeito do uso de vitamina E em pacientes com NASH não foram encontradas diferenças estatisticamente significativas com o uso de placebos e outras opções terapêuticas, a curto prazo, existe preocupação sobre os possíveis efeitos adversos do uso prolongado de Vitamina E.
Uma revisão sistemática de nove randomizados incluídos novos, randomizado, placebo-controlados, a fim de avaliar os efeitos da vitamina E para um período de, pelo menos, um ano na incidência de acidentes vasculares, bem como subtipos de acidente cerebrovascular. Ele encontrou um risco aumentado de AVC hemorrágico (RR = 1, 22, 95% IC: 1, 0 a 1, 48, p = 0, 045). Devido aos resultados obtidos em sua revisão, os pesquisadores recomendam evitar o uso indiscriminado de vitamina E devido às graves consequências dos derrames hemorrágicos na morbilidade e mortalidade (29).
um estudo aleatorizado, controlado com placebo, que incluiu 35.533 doentes seguidos durante um mínimo de sete anos, estudou os riscos de vitamina E relacionados com o cancro da próstata. Comparou um grupo placebo com um grupo a receber vitamina e numa dose diária de 400 UI. Houve um aumento significativo do risco de cancro da próstata entre os que tomaram vitamina E (HR 1, 17; IC 99%, 1, 004-1, 360; p = 0, 008). O aumento absoluto do risco foi de 1,6 por 1000 pessoas / ano (30).
outra meta-análise analisou a relação dose-resposta da suplementação de vitamina E e a mortalidade total em adultos. Demonstrou que os doentes que recebem doses elevadas de vitamina e (superiores ou iguais a 400 UI/dia) apresentaram um aumento da mortalidade por todas as causas. Esta meta-análise limitou a sua pesquisa a ensaios controlados aleatórios cujas amostras de doentes consistiam em adultos que recebiam tratamento com vitamina E ISOLADAMENTE ou em combinação com outras vitaminas ou minerais e que excluíam mulheres grávidas e que tinham um mínimo de 1 ano de tratamento e monitorização. Os resultados fornecidos por esta meta-análise devem ser considerados com precaução, uma vez que vários dos estudos têm pequenas dimensões de amostra e foram realizados em doentes com várias doenças crónicas. Isto limita a capacidade do estudo de generalizar resultados para a população adulta saudável (31).
CONCLUSÃO
Embora não haja atualmente nenhum medicamento eficaz terapia para pacientes com NASH, que os dados apresentados pelo PIVENS estudo sugere que a administração adequada de vitamina E melhora a histologia do fígado em adultos não-cirróticos pacientes com NASH que não têm diabetes. No entanto, mais estudos são necessários antes que esta recomendação pode ser estendida a pacientes diabéticos ou a pacientes que têm cirrose com NASH. Estudos realizados em pacientes pediátricos com NASH não encontraram evidência suficiente para apoiar o uso de vitamina E. Além da administração de vitamina E, tem sido demonstrado que a perda de peso reduz a esteatose e inflamação hepática. Em todos os doentes deve ser recomendada a perda de peso através de uma dieta com baixas calorias combinada com um aumento da actividade física. Quanto aos efeitos secundários, não encontrámos diferenças estatisticamente significativas no uso a curto prazo da vitamina E com placebos e outras opções de tratamento. Ainda assim, o uso indiscriminado de vitamina E não é recomendado por longos períodos de tempo, uma vez que existem evidências que sugerem um aumento dos riscos de câncer de próstata, acidente vascular cerebral hemorrágico e morte por todas as causas.
1. Abbas AK, Fausto N. Hígado, vesículo biliar y vias biliares. En: Robbins SL, Mitchell RN, Kumar V, Abbas ak, Fausto N. Patología funcional y estructural. 8va Ed. Barcelona: Elsevier; 2012. P. 645-687.
2. Brunt E, Neuschwander-Tetri B, Burt AD. Doença do fígado gordo: alcoólica e não alcoólica. Burt AD, Ferrell, l Portmann BC. A patologia do fígado de MacSween. 6th edition. UK: Elservier; 2012. P. 293-359.
3. Corrado RL, Torres DM, Harrison SA. Revisão das opções de tratamento para a doença hepática gordurosa não-alcoólica. Med Clin N Am 2014; 98: 55-72.
4. Koek GH, Liedorp PR, Bast A. O papel do stress oxidativo na esteatohepatite não alcoólica. Clinica Chimica Acta 2011; 412: 1297-1305.
5. Cortez-Pinto H, Ermelinda Camilo M. Doença hepática gorda não alcoólica/esteatohepatite não alcoólica (NAFLD/NASH): diagnóstico e curso clínico. Best Practice & Research Clinical Gastroenterology 2004; 18 (6): 1089-104.
6. Mishra A, Younossi ZM. Epidemiologia e História Natural de doença hepática gorda não alcoólica. Journal of Clinical and Experimental Hepatology 2012; 2(2): 135-44.
7. Rolo AP, Teodoro JS, Palmeira CM. Papel do stress oxidativo na patogénese da esteatohepatite não-alcoólica. Free Radic Biol Med 2012; 52 (1): 59-69.
8. Machado MV, Cortez-Pinto H. Diagnóstico não invasivo de doença hepática gorda não alcoólica. Critico. Journal of Hepatology 2013; 58 (5): 1007-19.
9. Chalasani N, et al. The Diagnosis and Management of Non-Alcoholic Fatty Liver Disease: Practice Guideline by the American Association for the Study of Liver Diseases, American College of Gastroenterology, and the American Gastroenterological Association. Hepatologia 2012; 55.
10. Mazzella N, Ricciardi LR, Mazzotti a, Marchesini G. O papel dos medicamentos para a gestão de pacientes com NAFLD. Clin Liver Dis 2014; 18: 73-89.
11. Chunga MY, Yeunga SF, Parka HJ, Volekb JS, Brunoa RS. A suplementação dietética α-e γ-tocoferol atenua o stress oxidativo induzido pelo lipopolissacárido e as respostas inflamatórias relacionadas num modelo de rato obeso de esteatohepatite não-alcoólica. Journal of Nutritional Biochemistry 2010; 21: 1200-1206.
12. Dia CP, James OF. Esteatohepatite: a tale of two hits? Gastroenterology 1998; 114: 842-4.
13. Harper HA, Murray RK, Rodwell VW, Bender DA. Bioquímica Illustrada, 28 ed. México: McGraw-Hill Interamericana; 2010. P. 484-485.
14. Neuschwander-Tetri BA. Lipotoxicidade hepática e patogénese da esteatohepatite não-alcoólica: o papel central dos metabolitos dos ácidos gordos não-triglicéridos. Hepatology 2010; 52(2): 774-88.
15. Le T, Loomba R. manage of Non-alcoholic Fatty Liver Disease and Steatohepatitis. Journal of Clinical and Experimental Hepatology 2012; 2: 156-173.
16. Verdam FJ, Dallinga JW, Driessen, de Jonge C, Moonen E, van Berkel J, Luijk J, Bouvy ND, Buurman AW, Rensen SS, Greve JW. Esteatohepatite não alcoólica: um diagnóstico não invasivo através da análise da respiração expirada. Journal of Hepatology 2013; 58: 543-548.
17. Palmentieri B, De Sio I, La Mura V, et al. O papel do padrão de eco do fígado brilhante no exame de ultra-som b-mod no diagnóstico de esteatose hepática. Dig Liver Dis 2006; 38: 485-9.
18. Sanyal AJ, et al. Pioglitazona versus vitamina E versus placebo para o tratamento de doentes não diabéticos com esteatohepatite não alcoólica: concepção do ensaio PIVENS. Contemp Clin Trials 2009; 30(1): 88-96.
19. Sanyal AJ, Chalasani N, Kowdley KV, McCullough a, Diehl AM, Bass NM, et al. Pioglitazona, vitamina e ou placebo para esteatohepatite não-alcoólica. N Engl J Med 2010; 362 (18): 1675-85.
20. Hoofnagle JH, Van Natta ML, Kleiner de, Clark JM, Kowdley KV, Loomba R, et al. Vitamina E e alterações dos níveis séricos de alanina aminotransferase em doentes com esteatohepatite não alcoólica. Aliment Pharmacol Ther 2013; 38(2):134-43.
21. Lavine JE, Schwimmer JB, Molleston JP, Scheimann AO, Murray KF, Abrams SH, et al. Treatment of nonalcoholic fatty liver disease in children: tónico trial design. Contemp Clin Trials 2010; 31(1): 62-70.
22. Lavine JE, Schwimmer JB, Van Natta ML, et al. Efeito da vitamina E ou metformina no tratamento da doença do fígado gordo não-alcoólica em crianças e adolescentes: o ensaio clínico controlado com tónico. JAMA 2011; 305(16): 1659-68.
23. Yakaryilmaz F, Guliter S, Savas B, Erdem o, Ersoy R, Erden E, et al. Efeitos do tratamento com vitamina E na expressão Alfa-receptor activada pelo proliferador de peroxissoma e na resistência à insulina em doentes com esteatohepatite não alcoólica: resultados de um estudo-piloto. Intern Med J 2007; 37 (4): 229-35.
24. Vajro P, Mandato C, Franzese a, Ciccimarra E, Lucariello S, Savoia M, et al. Tratamento da vitamina E em doenças hepáticas relacionadas com a obesidade pediátrica: um estudo aleatorizado. J Pediatr Gastroenterol Nutr 2004; 38(1): 48-55
25. Papastergiou V, et al. Nove modelos de pontuação para a mortalidade a curto prazo na hepatite alcoólica: validação cruzada numa coorte de biopsia. Aliment Pharmacol Ther 2014; 39: 721-732.
26. Kugelmas M, Hill DB, Vivian B, Marsano L, McClain cj. Cytokines and NASH: a pilot study of the effects of lifestyle modification and vitamin E. Hepatology 2003; 38(2): 413-9.
27. Younossi ZM, Reyes MJ, Mishra MA, Mehta R, Henry L. Systematic review with meta-analysis: non-alcohol steatohepatitis – a case for personalized treatment based on pathogenic targets. Farmacol Alimentar2014; 39: 3-14.
28. Ji HF, et al. Efeito da suplementação com vitamina e nos níveis de aminotransferase em doentes com NAFLD, NASH e CHC: resultados de uma meta-análise. Nutrition 2014; 1-6.
29. Markus S, Robert JG, Pamela MR, Christophe T, Tobias K. Effects of vitamin E on stroke subtypes: meta-analysis of randomised controlled trials. BMJ 2010; 341.
30. Klein EA, Thompson IM, Tangen CM, et al. Vitamina E e risco de cancro da próstata: ensaio de prevenção do cancro do selénio e da vitamina E (select). JAMA 2011; 306(14): 1549-56.
31. Miller ER, 3rd, Pastor-Barriuso R, Dalal D, Riemersma RA, Appel LJ, Guallar E. Meta-análise: a suplementação de alta dosagem de vitamina E pode aumentar a mortalidade por todas as causas. Ann Intern Med 2005; 142(1): 37-46.