Iontové Elektrolyty
Vodě a jiných polárních molekul jsou přitahovány ionty, jak je znázorněno na Obrázku \(\PageIndex{2}\). Elektrostatická přitažlivost mezi iontem a molekulou s dipólem se nazývá ion-dipólová přitažlivost. Tyto atrakce hrají důležitou roli při rozpouštění iontových sloučenin ve vodě.
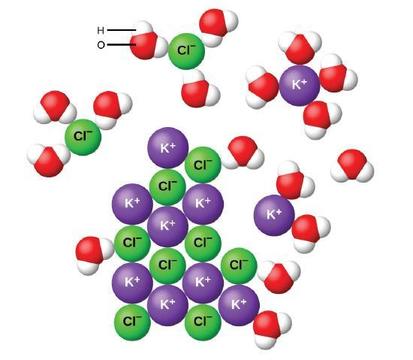
Když iontové sloučeniny se rozpustí ve vodě, ionty v pevné oddělit a rozptýlit rovnoměrně po celém řešení, protože molekuly vody, které obklopují a solvate iontů, čímž se snižuje silné elektrostatické síly mezi nimi. Tento proces představuje fyzickou změnu známou jako disociace. Za většiny podmínek se iontové sloučeniny po rozpuštění téměř úplně disociují, a proto jsou klasifikovány jako silné elektrolyty.
uvažujme, co se stane na mikroskopické úrovni, když přidáme pevnou KCl do vody. Ion-dipól síly přitahují pozitivní (vodík) konec polární molekuly vody na negativní chloridových iontů na povrchu pevné látky, a oni přitahují negativní (kyslík), končí na pozitivní ionty draslíku. Molekuly vody pronikají mezi jednotlivými K+ a Cl− iontů a je obklopují, snížení silný interionic sil, které se vážou ionty dohromady a nechat je přesunout do roztoku jako solvated ionty, jako Obrázek ukazuje. Snížení elektrostatické přitažlivosti umožňuje nezávislý pohyb jednotlivých hydratovaných iontů ve zředěném roztoku, což vede k zvýšení neuspořádanosti systému jako ionty změnit z jejich pevné a nařídil pozice v crystal na mobil a mnohem více neuspořádané státy v řešení. Tato zvýšená porucha je zodpovědná za rozpouštění mnoha iontových sloučenin, včetně KCl, které se rozpouštějí absorpcí tepla.
V jiných případech, elektrostatické atrakce, mezi ionty v krystalu jsou tak velké, nebo ion-dipól přitažlivé síly mezi ionty a molekuly vody jsou tak slabé, že zvýšení porucha nemůže kompenzovat energii potřebnou k oddělení iontů, a krystal je nerozpustný. To je případ sloučenin, jako je uhličitan vápenatý (vápenec), fosforečnan vápenatý (anorganická složka kosti) a oxid železa (rez).