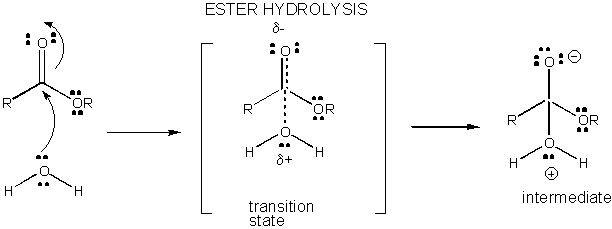
Reakce v roztoku, které nejsou katalyzované jsou pomalé, protože starosti rozvoj a separace se vyskytuje v přechodném stavu. Při vytváření nebo rozbití vazeb se často vytvářejí nabité meziprodukty, které mají vyšší energii než reaktanty. Od prostřední je vyšší energii než reaktanty, přechodový stav by byl ještě vyšší, v energii, a proto se více podobají nabité střední. Cokoliv, co může stabilizovat poplatky na střední a proto rozvojových poplatky při přechodu státy budou nižší energie přechodového stavu a katalyzují reakce. V této části budeme zkoumat mechanismus, který je základem katalýzy malými molekulami chemických reakcí. Předpokládá se, že biologický makromolekulární katalyzátor (jako proteinové enzymy) použije podobné mechanismy ve svých katalytických účincích (které budou popsány v další části).
katalyzátory, včetně enzymů, mohou používat nejméně 5 různých způsobů stabilizace přechodových stavů.
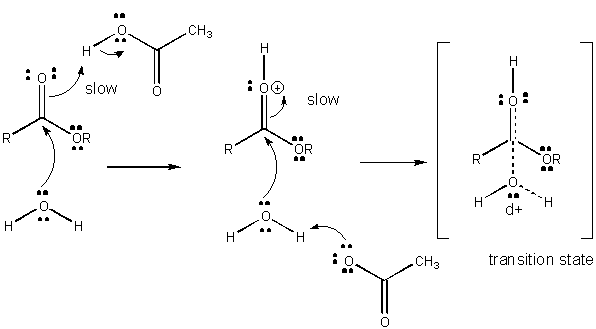
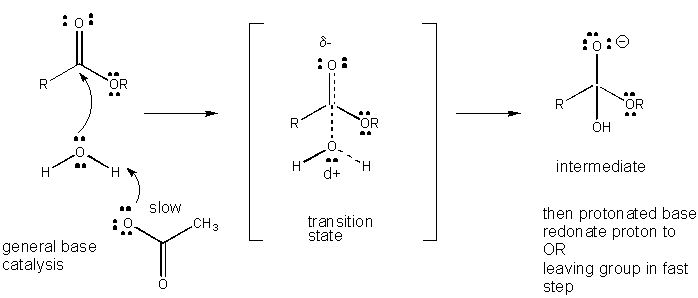
Poplatek vývoj v TS může být snížena tím, že buď darování protonu z obecné kyseliny (jako je kyselina octová nebo protonované indolový kruh) na atom jako je karbonylová O které se vytváří parciální záporný náboj v TS, když je připojen nukleofil. Darování protonů snižuje vyvíjející se negativní v TS. Alternativně, nukleofil jako voda, která vytváří částečný kladný náboj v TS, jak to začne tvořit pouto k elektrofilní C v karbonylové může být stabilizován přítomností obecného základu (jako acetát nebo deprotonated indolový prsten). Proton abstrakce snižuje rozvíjet kladný náboj
Obrázek: POPLATEK VÝVOJ V PŘECHODU STÁTU PRO HYDROLÝZA ESTERU
Obrázek: MECHANISMUS OBECNÉ KYSELÉ KATALÝZY
Obrázek: MECHANISMUS OBECNÉ ZÁKLADNÍ KATALÝZY
Přispěvatelé a Pravomocí
- Prof. Henry Jakubowski (College of St. Benedict/St. John ‚ s University)