Hořčík sodný, také známý jeho název podle IUPAC hořčíku, hydrogenuhličitanu, je sůl obsahující sodný anion a kation hořčíku zastoupen vzorec C2H2MgO6 nebo Mg(HCO3)2 . Vzhledem k tomu, že hydrogenuhličitan hořečnatý je nestabilní v pevném stavu, existuje ve zředěném vodném roztoku .
Hořčík Sodný Identifikace |
|
| Číslo CAS | 2090-64-4 |
| PubChem CID | 102204 |
| ChemSpider ID | 92335 |
| Číslo ES | 235-192-7 (EU látky zlepšující vlastnosti Potravin)
218-240-1 (ECHA) |
| UNII | 19E9A0647O |
| InChI Klíč | QWDJLDTYWNBUKE-UHFFFAOYSA-L |
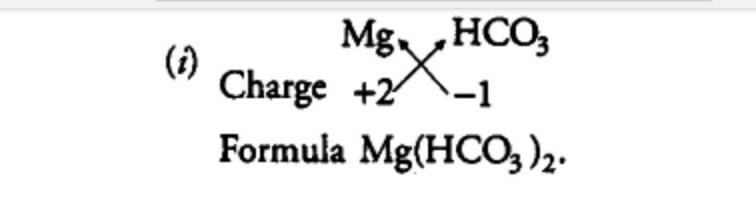
Hořčík Sodný Vzorec,
Jak je Hydrogenuhličitanu Hořčíku Připravených
To může být syntetizován působením hořčíku acetátu s hydrogenuhličitan sodný, zahrnující následující reakce:
Mg(CH3COO)2 + 2NaHCO3 → Mg(HCO3)2 + 2CH3COONa
roztok Mg(HCO3)2 běžně nazývá hořčíku, hydrogenuhličitanu vody může být vyvolán reakcí hydroxidu hořečnatého (jako je mléko magnesia) a pod tlakem oxidu uhličitého (jako minerálka) :
Mg(OH)2 + 2CO2 → Mg(HCO3)2
výsledný roztok při sušení se rozkládá hořčíku, hydrogenuhličitanu na uhličitan hořečnatý, vodu a oxid uhličitý:
Mg + 2HCO3 → MgCO3 + CO2 + H2O

Hořčík Sodný
Vlastnosti a Charakteristiky Hořčíku, Hydrogenuhličitanu
Obecné Vlastnosti |
|
| Molární Hmotnost/Molekulární Hmotnost | 146.337 g/mol |
Fyzikální Vlastnosti |
|
| Barva a Vzhled | Světlo, bílá, nestabilní drobivá hmota nebo prášek |
| Zápach | bez Zápachu |
| Tání | N/A |
| Bod Varu | 333.6 °C, 632.48 °F |
| Náboj | 0 (Mg2+ a HCO3–) |
| skupenství při pokojové teplotě | Nestabilní v pevné formě, ale existuje v kapalném stavu |
| Rozpustnost | Nerozpustný v ethanolu |
| Rozpustnost ve Vodě | Téměř nerozpustný ve vodě (0.077 g na 100 mL) |
Používá
- Hořčíku, hydrogenuhličitanu má mnoho zdravotních výhod a je používán pro odolávání změnám v pH krve a udržet ji v optimálním rozmezí .
- jako esenciální minerál pomáhá při regulaci krevního tlaku, syntéze bílkovin, nervových a svalových funkcích a kontrole glukózy v krvi v lidském těle .
- používá se jako potravinářské přídatné látky, jako jsou regulátory kyselosti, alkálie, Anti-krakování a bělící činidla .
- Uhličité Kyseliny, Hořečnaté Soli (2:1) – Pubchem.ncbi.nlm.nih.gov
- Hydrogenuhličitanu Hořčíku – Mg(HCO3)2 – Byjus.com
- Stearan Sodný – Chemspider.com
- Příprava Roztoků Hydrogenuhličitanu Hořčíku pro Odkyselení – Jstor.org
- Hořčík Sodný Voda – význam hydrogenuhličitany a hořčíku – Dancingwithwater.com
- Regulátory Kyselosti – Chm.bris.ac.uk