- Plasticita VSMCs za Fyziologii a Nemoci
- VSMCs Vliv Adventitia Imunitní Reakce u Hyperlipidemických Myši
- stárnutí nebo Chronicita nebo obojí?
- Nově Vytvořené Adventitia Struktur Účasti v atlo Funkce tím, že podporuje Recirkulace Lymfocytů
- Atlo Tvorba je Vysoce Territorialized což Naznačuje, že Signály jsou Přenášeny Z Desky na Adventitia přes Lymfatické Tkáně Organizátor-Jako VSMCs
- VSMCs Přímo Přispívají k Adventitia Imunity v Aterosklerózy
- závěr
- autorské příspěvky
- finanční Prostředky
- Střet Zájmů Prohlášení
Plasticita VSMCs za Fyziologii a Nemoci
buňkách hladké svaloviny Cév (VSMCs) jsou hlavní složky střední a velké tepny. I když mechanismy aterogenní do značné míry zůstávají definovány, studie prokázaly, že progrese onemocnění zahrnuje přeslechy mezi buňky imunitního systému, jak s ECs a VSMCs. Některé z těchto interakcí podporovat růst plaku, zatímco jiní zmenšit velikost, buněčné složení a stability aterosklerotických plátů (1, 2) (Obrázek 1, Tabulka 1). VSMCs show pozoruhodné plasticitu v reakci na poranění cév, zánět a hromadění lipoproteinů v průběhu progrese onemocnění prostřednictvím přeprogramování genové exprese a přechod do proliferační, pro-migrační a aktivovaný fenotyp, tj. fenotyp přepínání (5). Na obrázku 1, zobrazujeme kritické molekulární přepínače, které byly navrženy jako důležité regulátory progrese onemocnění(3, 6, 8, 11). Během iniciace aterosklerózy se monocyty odvozené od krve, které byly přijaty do intimy, hromadí lipidy, což jim dává pěnivý vzhled. Tyto pěnové buňky přispívají k tvorbě tukových pruhů, což představuje nejčasnější a možná reverzibilní Stadium aterosklerotických plátů. Tukové proužky se postupně rozvíjet do atheromas/plakety v konečném důsledku vede k rozšířené plaky, které obsahují VSMCs, T buňky a myeloidní buňky (Obrázek 1) (33). Je zajímavé, složení aterosklerotického plátu, spíše než jeho velikost určuje jeho stabilitu jako fibrózní uzávěr tloušťka a nekrotické jádro velikosti jsou potenciální znaky stabilní vs. nestabilní deska, respektive (4, 9). VSMCs v intima vrstva jsou tradičně vnímány jako prospěšné při aterogenní, protože produkují extracelulární matrix komponent, a tím podporovat tvorbu silnější vazivové čepičky což vede k ochraně proti plaku ruptura (4, 9). Je stále více zřejmé, že VSMCs podstoupit nepřeberné množství strukturální a funkční phenotypical transformací a dokonce může zcela ztratit svou nativní funkce pro získání vlastnosti jiných typů buněk, včetně makrofágů. Data ukazují, že VSMCs může získat dichotomický fenotypy s Janus hlava-typ povahy, tj. pro vs. anti-aterogenní vlastnosti, v závislosti na tkáni prostředí a působení rizikových faktorů (3). VSMCs uvolnění cytokinů stimulovat přilehlé ECs vyjádřit adhezní molekuly a cytokiny, a/nebo zvýšení chemotaxe z monocytů/makrofágů do plaku (3, 34, 35) (Tabulka 1). Tyto údaje naznačují, že akumulace VSMCs v vláknité čepici nebo intima jsou prospěšné, vzhledem k tomu, že jejich ztráty nebo přechod do zánětlivého fenotypu jsou škodlivé, a že rovnováha mezi VSMCs proliferace a migrace vs. smrt/senescence určuje atheroprogression vs. plaku stability (3). Různé další aspekty biologie VSMC ve zdraví a nemoci byly nedávno pokryty řadou vynikajících recenzí (https://academic.oup.com/cardiovascres/issue/114/4) a nebudou zde zahrnuty. Níže se proto zaměřujeme na roli adventitie a potenciální dopad Vsmc na formování ATLO.

Obrázek 1. Fenotypy Vsmc během progrese aterosklerózy odhalují mimořádnou plasticitu. ECs a Vsmc v aterosklerotických placích vykazují aktivované fenotypy ( ➊ ) (3, 4). Některé z Vsmc pocházejí z médií po náboru do intimy; jiné Vsmc mohou pocházet z kostní dřeně nebo mohou pocházet z myeloidních buněk v oběhu ( ➋ ) (3). Frakce Vsmc proliferuje ( ➌ ) (3, 5). VSMCs vylučují extracelulární matrix komponent; pluripotentní transkripční faktor, tj., Klf4, může hrát významnou roli v procesu označuje jako fenotyp přepínání (➍) (6, 7). V pokusech na štít aterosklerotického plaku z smrtící prasknutí, Oct4 může ovládat proces, který byl nazván remigration tvořit fibrózní kryt (➎) (4, 8-10). Senescence a apoptózy spouštěčem vzniku dalších zánětlivých cytokinů, tvoří nekrotické jádro zahájení bludný kruh se smrtící klinické důsledky v pozdních fázích onemocnění (➏) (3, 4, 11).
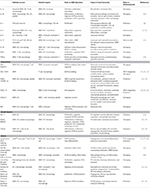
Tabulka 1. Klíčové zánětlivé mediátory zapojené do imunity aterosklerózy zprostředkované VSMC.
VSMCs Vliv Adventitia Imunitní Reakce u Hyperlipidemických Myši
Během posledních dvou desetiletí, bylo stále zřejmější, že adventitia je velmi složitý a imunologicky aktivní tkáň přechovávání buněk tak rozmanité jako stromální buňky, nervy, lymfatické cévy, vasa vasora, a rezidentních leukocytů/progenitorové buňky, které mají schopnost ovlivnit průběh onemocnění (36, 37). Pozorovali jsme, že adventitia myší ApoE – / – prochází významnými restrukturalizačními událostmi během všech stadií aterosklerózy: Jak vrozené, tak adaptivní imunitní buňky se hromadí vedle sousedních aterosklerotických plátů (Obrázek 2). Navíc, naše studie u experimentálních myší byly potvrzeny v lidské nemocných tepen: My a ostatní pozorované ATLO-jako struktury v adventitia pacientů léčících se s aterosklerotické aortální výdutě (38, 39), a více nedávno, Akhavanpoor et al. pozorováno dobře vyvinuté ATLOs v adventitii značného procenta pacientů postižených ischemickou chorobou srdeční (40). U myší aterosklerózy jsou prominentními rysy tohoto restrukturalizačního procesu lymfatické cévy, high endotelial venule (HEV) a neogeneze krevních cév (16, 41).
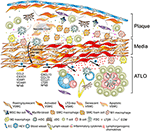
Obrázek 2. Buňky hladkého svalstva cév (VSMC) se účastní imunity adventitia během tvorby plaku. VSMCs vklíněná mezi aterosklerotických plátů a adventitia přijmout lymfatické tkáně organizátor-jako fenotyp následující aktivace přes plaku získaných podnětů (➊) a následně transdifferentiate do LTo-jako buňky (➋). Prostřednictvím jejich proliferační a cytokinů-vyjádření fenotypu mají vliv na restrukturalizaci a vyřezávání adventitia včetně angiogeneze, HEV formace, a lymfatické cévy neogenesis (➌). Fenotyp přepínání také výsledky v expresi a sekreci lymphorganogenic chemokines, tj. CXCL13 a CCL21, a tím podporovat ATLO tvorbu schematicky znázorněno v dolní části grafu (➍).
stárnutí nebo Chronicita nebo obojí?
důležité je, že stárnutí bylo zjištěno jako hlavní determinant restrukturalizace a sochařství adventitia. Plně vyvinutá forma ATLOs během pokročilých stadií aterosklerózy, ale jejich počáteční stadia, tj. agregáty t / b buněk, se objevují paralelně s tvorbou aterosklerotických plátů (16, 27, 41, 42). Tyto rané ATLOs se skutečně tvoří ve věku ~30 týdnů a dosahují pokročilejších stadií kolem 52 týdnů až k vrcholu v 78 týdnech (16, 41). Podobné vývojové stadia Tlos závislé na věku byly pozorovány u jiných chronických neřešitelných onemocnění (1, 42). Tyto údaje naznačují, že vývoj ATLO je závislý na věku a stárnutí je pozitivně spojeno s adventním sochařstvím (Obrázek 2). Nicméně, vztah mezi stárnutím a chronicity je obtížné studovat v myších aterosklerózy jako aterosklerotického plátu vývoj začíná v oblouku aorty, pak putuje zaseto aorty dosáhnout břišní aorty v pozdějších fázích onemocnění, tedy brát delší dobu. Je zapotřebí více práce k objasnění důležité otázky, zda senescence imunitních buněk a/nebo vsmc přispívá k tvorbě ATLO a které typy buněk, tj. Jsou zapojeny vsmc, ECs a/nebo imunitní buňky. Studium v jiných formách ŽÚ formace, jako jsou ty, vyskytující se v plicích a gastrointestinálním traktu by naznačovalo, že to je chronicity přetrvávající zánětlivé reakce tkáně spíše než bona fide stárnutí události imunitní systém, který je zásadním způsobem přispívá k tvorbě ATLOs (43, 44).
Nově Vytvořené Adventitia Struktur Účasti v atlo Funkce tím, že podporuje Recirkulace Lymfocytů
Pokročilé ATLO fáze patří T/B buněčných agregátů, zárodečných center v aktivované B-buňky folikulů, lymfatických cév, Hybridů v T oblasti buněk a extracelulární conduit meshworks (16). Tyto zásadní změny se podobají struktury připomínající ty, které našel v sekundárních lymfoidních orgánů, kde se prosazovat základní aspekty imunitní odpovědi vůči antigenu, včetně recirkulace naivní lymfocyty najít jejich kognitivní antigeny/autoantigens a organizování afinitní maturace B buněk směrem k potenciální autoantigens. Pomocí adoptivní lymfocytů přenos studií, pozorovali jsme, že ATLOs výrazně zvýšit lymfocytů nábor do arteriální stěny tím, jak podporovat přistěhovalectví a současné zeslabení emigrace antigen-nezkušený lymfocyty (27). Po jejich náboru se T buňky aktivují, začnou proliferovat a některé z pomocných buněk CD4 T jsou přeměněny na indukované regulační buňky T. Tyto údaje ukazují, že imunitní systém v adventitii je vysoce citlivý na základní zánětlivou tkáňovou reakci arteriální stěny. Navíc, B buněk, které tvoří germinativní centra, v aktivovaných B buněk folikulů objeví podstoupit zárodečných center reakce v přítomnosti folikulárních dendritických buněk, kde některé jsou převedeny do paměťových B-buněk, zatímco jiní opustí zárodečných center, aby se stal plazmatické buňky (45). Když se tyto údaje vezmou dohromady, naznačují, že ATLOs spíše než sekundární lymfoidní orgány (jak se dříve myslelo) organizují imunitu aterosklerózy.
Atlo Tvorba je Vysoce Territorialized což Naznačuje, že Signály jsou Přenášeny Z Desky na Adventitia přes Lymfatické Tkáně Organizátor-Jako VSMCs
Další aspekt adventitia restrukturalizace během aterogenní je, že ATLO tvorba je vysoce territorialized být do značné míry omezena na adventitia segmentů přiléhajících k aterosklerotických plátů břišní aorty u myší (16, 45). ATLOs jsou jen občas našel v adventitia z inominátní tepny nebo z aortálního oblouku, kde aterosklerózy je nejvíce prominentní. Imunitní buňky v hrudních segmentech aorty se skládají hlavně z agregátů T buněk ve srovnání s ATLOs v břišní aortě (16, 41). Přesný mechanismus teritoriality tvorby ATLOs v břišní aortě je stále neznámý. TLOs se jeví jako rys mnoha chronických neřešitelných zánětlivých onemocnění a jsou prominentními znaky autoimunitních onemocnění (42). Celularita a struktury TLOs u aterosklerózy jsou podobné TLOs u mnoha dalších chronických onemocnění, včetně tvorby tlo spojené s rakovinou (46, 47). Oblasti ŽÚ biologie dramaticky rozšířila v posledních letech výchovu důležitou možnost, že nový terapeutický cíl může být identifikován prostřednictvím pochopení ŽÚ je funkce v každém z ŽÚ-přidružených onemocnění. Různé typy TLOs však odhalují některé specifické rysy onemocnění, které mohou nakonec určit, zda jsou související imunitní odpovědi škodlivé nebo ochranné. Takové charakteristiky specifické pro onemocnění pravděpodobně vznikají jedním z několika mechanismů, včetně orgánové specifičnosti a povahy poškození tkáně (1, 42). Vývoj lymfoidních orgánů je komplexní proces, který zahrnuje buňky induktoru hematopoetické lymfoidní tkáně (LTi), buňky nehematopoetické stromální lymfoidní tkáně (LTo) a signalizaci LTßR. Naše in-vitro studie myší aorty VSMCs uvedeno, že při vhodné stimulaci mohou sloužit jako LTo-jako buňky (20), původně zjištěné během embryonálního vývoje během vznik sekundárních lymfoidních tkání včetně lymfatických uzlin a sleziny (48, 49) (viz níže). Je důležité si uvědomit, že se zdá, že ATLOs zahrnují Vsmc jako důležité účastníky, zatímco jiné TLOs zahrnují jiné LTo-podobné mezenchymální buňky (50). Společným jmenovatelem všech forem TLOs, nicméně, se zdá být–na rozdíl od sekundárních lymfoidních orgánů–chronické zánětlivé tkáňové reakce, které řídí imunitní systém tvoří tyto lymfoidních struktur v blízkosti nebo v některých případech do nemocné tkáně (42, 43).
VSMCs Přímo Přispívají k Adventitia Imunity v Aterosklerózy
vzhledem k vysoce territorialized povahu ATLOs sousedí s aterosklerotických plátů, domlouvali jsme se, že VSMCs mohou být zapojeny v ATLO formace a ze stejného důvodu může přijmout funkční roli v progresi aterosklerózy. Vsmc vysoce exprimují LTßR konstitutivně (16), zatímco jeho ligand LTa1ß2 je exprimován na různých imunitních buňkách nazývaných LTI buňky (51). Předpokládá se, že vsmc jsou aktivovány signální cestou LTßR-LT buňkami LTi zapojenými do neogeneze sekundární lymfoidní tkáně. Původ LTI buněk nebyl dosud jasně stanoven, ačkoli aktivované makrofágy a další imunitní buňky v plaku intimy jsou kandidáty na tuto aktivitu v NEOGENEZI LTO. V reakci na buněčné a rozpustné mediátory VSMCs objeví podstoupit výraznou typ fenotyp přepnutí na LTo-jako fenotyp prostřednictvím parakrinní sekrece lymphorganogenic chemokines, tj. CXCL13 a CCL21, čímž přitahuje imunitní buňky, např. makrofágy/dendritické buňky, T buňky a B buňky k místní adventitia prostředí, což vede ke vzniku ATLO v adventitia (27, 41, 45) (Tabulka 1). Globální nebo VSMC-konkrétní nedostatek LTßR ve věku hyperlipidemických ApoE−/− myší prokázala zvýšenou aterosklerotického plaku formace, což naznačuje, že VSMC LTßR má schopnost zmírnit rozvoj aterosklerózy pod některé experimentální podmínky (27). Jiné studie však ukázaly, že mladí globální ApoE−/− lt br−/−myší udržována pod vysokým obsahem tuku strava (HASIČE), bylo zjištěno nižší aortální deska zátěž, než je jejich běžné stravy krmených ApoE−/− protějšků (52). Tyto zjevné protichůdné údaje naznačují, že role LTßR u mladých myší a za podmínek nadměrné hyperlipidémie se mohou u obou modelů lišit. Alternativně může být za tyto rozdíly zodpovědná strava s vysokým obsahem tuku, která vede k dramatickým a možná omamným hladinám plazmatických lipidů. Od té doby jsme se pravidelně používají high tuk stravy v ApoE−/− myší, tyto rozdíly zůstávají nevyřešené otázky i když bylo prokázáno, že imunitní systém může být přemožen extrémní hladiny plazmatických lipidů . Tyto údaje vyžadují další studie zkoumat molekulární základ pro zdánlivou dichotomii LTßR v progresi aterosklerózy u mladých vs. věku myší a/nebo brzy vs. pokročilé aterosklerózy. Kromě toho mohou makrofágy odvozené z kostní dřeně fungovat jako LTi buňky nezávislé na LTßR a vyvolat expresi CCL19, CCL20 a CXCL16 pomocí Vsmc (53) (Tabulka 1). Tak, VSMCs může podílet na tvorbě TLOs v aterosklerózy tím, že upregulace lymphorganogenic chemokines podporovat imunitní buňky agregáty v adventitia. Jak bylo uvedeno výše, ATLOs jsou běžné u lidí zatížených ischemickou chorobou srdeční (40) a u lidských aterosklerotických aneuryzmat aorty (38, 39). Když se užívá spolu, výskyt ATLOs v pokusných myší a lidské aterosklerózy vyvolávají důležité otázky o povaze aterosklerózy jako autoimunitní choroby: je možné, že během aterogenní autoimunitních T buněk a autoimunitní B-buněk namířených proti ještě musí být identifikovány autoantigens jsou generovány. Izolace takových autoimunitních lymfocytů včetně sekvenování jejich receptorů T buněk a / nebo receptorů B buněk by umožnila testovat hlavní hypotézy u aterosklerózy. Výzkum aterosklerózy by skutečně prošel velkým posunem a testování jednotlivých autoimunitních klonů lymfocytů ve funkčních systémech in vitro a in vivo by bylo možné.
závěr
ateroskleróza je zánětlivé onemocnění tepen. VSMCs komunikovat s ECs a imunitní buňky v aterosklerotických plátů a rezidentní buňky v adventitia. Tato schopnost umožňuje Vsmc ovlivnit imunitu aterosklerózy hlavními způsoby, včetně tvorby ATLOs. Další práce je nutné vymezit roli VSMCs v různých stádiích aterosklerózy, určit jejich role v mladé vs. stárnutí tepen, a objasnit další jejich dichotomický role v progresi onemocnění. Lepší pochopení těchto procesů může otevřít cestu k rozvoji terapeutických strategií pro budoucí intervence v klinicky důležité pozdních stádiích onemocnění.
autorské příspěvky
všichni autoři přispěli k návrhu, psaní a úpravě předloženého rukopisu a schválili jej k publikaci.
finanční Prostředky
Střet Zájmů Prohlášení
autoři prohlašují, že výzkum byl prováděn v nepřítomnosti jakékoli obchodní nebo finanční vztahy, které by mohlo být chápáno jako potenciální konflikt zájmů.
4. Clarke MC, Figg N, Maguire JJ, Davenport AP, Goddard M, Littlewood TD et al. Apoptóza buněk hladkého svalstva cév indukuje rysy zranitelnosti plaku při ateroskleróze. Nat Med. (2006) 12:1075–80. doi: 10.1038 / nm1459
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
5. Owens GK, Kumar MS, Wamhoff br. Molekulární regulace diferenciace buněk hladkého svalstva cév ve vývoji a onemocnění. Physiol Rev. (2004) 84: 767-801. doi: 10.1152 / physrev.00041.2003
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
6. Shankman LS, Gomez D, Cherepanova OA, Salmon M, Alencar GF, Haskins RM, et al. KLF4-dependentní fenotypová modulace buněk hladkého svalstva má klíčovou roli v patogenezi aterosklerotických plaků. Nat Med. (2015) 21:628–37. doi: 10.1038 / nm.3866
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
7. Gomez D, Owens GK. Fenotypové přepínání buněk hladkého svalstva při ateroskleróze. Cardiovasc Res. (2012) 95: 156-64. doi: 10.1093/cvr/cvs115
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
8. Cherepanova OA, Gomez D, Shankman LS, Swiatlowska P, Williams J, Sarmento z, et al. Aktivace pluripotenčního faktoru OCT4 v buňkách hladkého svalstva je ateroprotektivní. Nat Med. (2016) 22:657–65. doi: 10.1038 / nm.4109
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
10. Yla-Herttuala S, Bentzon JF, Daemen M, Falk E, Garcia-Garcia HM, Herrmann J, et al. Stabilizace aterosklerotických plátů. Poziční dokument pracovní skupiny Evropské kardiologické společnosti (ESC) pro aterosklerózu a vaskulární biologii. Trombóza. (2011) 106:1–19. doi: 10.1160/TH10-12-0784
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
11. Grootaert MOJ, Moulis M, Roth L, Martinet W, Vindis C, Bennett MR, et al. Smrt buněk hladkého svalstva cév, autofagie a stárnutí při ateroskleróze. Cardiovasc Res. (2018) 114: 622-34. doi: 10.1093/cvr/cvy007
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
14. Akhavanpoor M, Akhavanpoor H, Gleissner CA, Wangler S, doch AO, Katus HA, et al. Obě tváře interleukinu-17A při ateroskleróze. Curr Drogové Cíle. (2017) 18:863–73. doi: 10.2174/1389450117666161229142155
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
15. Jia G, Cheng G, Gangahar DM, Agrawal DK. Inzulín-jako růstový faktor-1 a TNF-alfa regulaci autofagie prostřednictvím c-jun N-terminální kinázy a Akt dráhy v lidských aterosklerotických cévních hladkých buněk. Imunolobuněčný Biol. (2006) 84:448–54. doi: 10.1111 / j. 1440-1711. 2006. 01454.x
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
16. Grabner R, Lotzer K, Dopping S, Hildner M, Radke D, Beer M, et al. Lymfotoxin beta receptor signalizační podporuje terciární lymfoidní organogeneze v aortě adventitia věku ApoE−/− myší. J Exp Med. (2009) 206:233–48. doi: 10.1084/jem.20080752
CrossRef Plný Text | Google Scholar
17. Damas JK, Smith C, Oie E, Fevang B, Halvorsen B, Waehre T, et al. Zvýšená exprese homeostatických chemokinů CCL19 a CCL21 v klinické a experimentální ateroskleróze: možná patogenní role při destabilizaci plaku. Arterioscler Thromb Vasc Biol. (2007) 27:614–20. doi: 10.1161 / 01.ČTYŘKOLKA.0000255581.38523.7c
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Doring Y, Noels H, van der Vorst EPC, Neideck C, Egea V, Drechsler M, et al. Vascular CXCR4 limits atherosclerosis by maintaining arterial integrity: evidence from mouse and human studies. Circulation. (2017) 136:388–403. doi: 10.1161/CIRCULATIONAHA.117.027646
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Akhtar S, Gremse F, Kiessling F, Weber C, Schober A. CXCL12 promotes the stabilization of atherosclerotic lesions mediated by smooth muscle progenitor cells in Apoe-deficient mice. Arterioscler Thromb Vasc Biol. (2013) 33:679–86. doi: 10.1161/ATVBAHA.112.301162
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Lotzer K, Dopping S, Connert S, Grabner R, Spanbroek R, Lemser B, et al. Mouse aorta smooth muscle cells differentiate into lymphoid tissue organizer-like cells on combined tumor necrosis factor receptor-1/lymphotoxin beta-receptor NF-kappaB signaling. Arterioscler Thromb Vasc Biol. (2010) 30:395–402. doi: 10.1161/ATVBAHA.109.191395
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
21. Smedbakken LM, Halvorsen B, Daissormont I, Ranheim T, Michelsen AE, Skjelland M, et al. Zvýšené hladiny homeostatického chemokinu CXCL13 u lidské aterosklerózy-potenciální role při stabilizaci plaku. Ateroskleróza. (2012) 224:266–73. doi: 10.1016 / j. ateroskleróza.2012.06.071
CrossRef Plný Text | Google Scholar
22. Higashi Y, Sukhanov S, Shai SY, Danchuk S, Tang R, Snarski P, et al. Nedostatek receptoru růstového faktoru-1 podobný inzulínu u makrofágů urychluje aterosklerózu a indukuje nestabilní fenotyp plaku u myší s deficitem apolipoproteinu E. Oběh. (2016) 133:2263–78. doi: 10.1161 / CIRCULATIONAHA.116.021805
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
23. Alexander MR, Owens GK. Epigenetická kontrola diferenciace buněk hladkého svalstva a fenotypové přepínání ve vaskulárním vývoji a onemocnění. Annu Rev Physiol. (2012) 74:13–40. doi: 10.1146/annurev-physiol-012110-142315
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
24. On C, Medley SC, Hu T, Hinsdale ME, Lupu F, Virmani R, et al. PDGFRbeta signalizace reguluje lokální zánět a synergizuje s hypercholesterolemií na podporu aterosklerózy. Nat Commun. (2015) 6:7770. doi: 10.1038/ncomms8770
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
26. Da Ros F, Carnevale R, Cifelli G, Bizzotto D, Casaburo M, Perrotta M, et al. Cílení Interleukin-1beta Chrání před Výdutí Aorty Vyvolané Narušení Transformující Růstový Faktor beta Signalizace. Imunita. (2017) 47: 959-73 e9. doi: 10.1016 / j. immuni.2017.10.016
CrossRef Plný Text | Google Scholar
27. Hu D, Mohanta SK, Yin C, Peng L, Ma Z, Srikakulapu P, et al. Tepny terciární lymfatické orgány kontrolní aorta imunitu a chrání proti ateroskleróze přes cévní hladké svalové buňky lymfotoxin beta receptory. Imunita. (2015) 42:1100–15. doi: 10.1016 / j. immuni.2015.05.015
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
29. Paramel Varghese G, Folkersen L, Strawbridge RJ, Halvorsen B, Yndestad A, Ranheim T, et al. Nlrp3 inflammasom exprese a aktivace u lidské aterosklerózy. J Am Srdce Doc. (2016) 5: e003031. diváci: 10.1161 / JAHA.115.003031
CrossRef Plný Text | Google Scholar
30. de Jong RJ, Paulin N, Lemnitzer P, Viola JR, Winter C, Ferraro B, et al. Ochranná schopnost annexinu A1 při tvorbě arteriální neointimy u myší náchylných k ateroskleróze-stručná zpráva. Arterioscler Thromb Vasc Biol. (2017) 37:312–5. doi: 10.1161/ATVBAHA.116.308744
CrossRef Plný Text | Google Scholar
32. van Gils JM, Derby MC, Fernandes LR, Ramkhelawon B, Ray TD, Rayner KJ, et al. Neuroimunitní naváděcí cue netrin-1 podporuje aterosklerózu tím, že inhibuje emigraci makrofágů z plaků. Nat Immunol. (2012) 13:136–43. doi: 10.1038 / ni.2205
CrossRef Plný Text | Google Scholar
35. Tchkonia T, Zhu Y, van Deursen J, Campisi J, Kirkland JL. Buněčná senescence a senescentní sekreční fenotyp: terapeutické příležitosti. J Clin Invest. (2013) 123:966–72. doi: 10.1172/JCI64098
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
37. Majesky MW, Horita H, Ostriker A, Lu S, Regan JN, Bagchi A, et al. Diferencované buňky hladkého svalstva generují subpopulaci rezidentních vaskulárních progenitorových buněk v adventitii regulované Klf4. Circ Res. (2017) 120: 296-311. doi: 10.1161 / CIRCRESAHA.116.309322
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
40. Akhavanpoor M, Gleissner CA, Akhavanpoor H, Lasitschka F, doch AO, Katus HA, et al. Adventitiální terciární klasifikace lymfoidních orgánů u lidské aterosklerózy. Kardiovaskulární Patol. (2018) 32:8–14. doi: 10.1016 / j. carpath.2017.08.002
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
41. Moos MP, John N, Grabner R, Nossmann S, Gunther B, Vollandt R, et al. Lamina adventitia je hlavním místem akumulace imunitních buněk u standardních myší s deficitem apolipoproteinu krmených jídlem. Arterioscler Thromb Vasc Biol. (2005) 25:2386–91. doi: 10.1161 / 01.ČTYŘKOLKA.0000187470.31662.fe
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
42. Mohanta SK, Yin C, Peng L, Srikakulapu P, Bontha V, Hu D, et al. Arteriální terciární lymfoidní orgány přispívají k vrozené a adaptivní imunitní odpovědi u pokročilé aterosklerózy myší. Circ Res. (2014) 114: 1772-87. doi: 10.1161 / CIRCRESAHA.114.301137
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
43. Buettner M, Lochner m. vývoj a funkce sekundárních a terciárních lymfoidních orgánů v tenkém střevě a tlustém střevě. Přední Imunol. (2016) 7:342. doi: 10.3389 / fimmu.2016.00342
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
45. Srikakulapu P, Hu D, Yin C, Mohanta SK, Bontha SV, Peng L, et al. Arteriální terciární lymfoidní orgány kontrolují vícevrstvé teritorializované aterosklerózy B-buněčné odpovědi ve věku ApoE– / — myší. Arterioscler Thromb Vasc Biol. (2016) 36:1174–85. doi: 10.1161/ATVBAHA.115.306983
CrossRef Plný Text | Google Scholar
48. van de Pavert SA, Mebius RE. Nové poznatky o vývoji lymfoidních tkání. Nat Rev Immunol. (2010) 10:664–74. doi: 10.1038/nri2832
CrossRef Plný Text | Google Scholar
50. Barone F, Gardner DH, Nayar S, Steinthal N, Buckley CD, Luther SA. Stromální fibroblasty v terciárních lymfoidních strukturách: nový cíl při chronickém zánětu. Přední Imunol. (2016) 7:477. doi: 10.3389 / fimmu.2016.00477
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
51. Scandella E, Bolinger B, Lattmann E, Miller S, Favre S, Littman DR, et al. Obnova integrity lymfoidních orgánů interakcí buněk induktorů lymfoidní tkáně se stromem zóny T buněk. Nat Immunol. (2008) 9:667–75. doi: 10.1038 / ni.1605
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
52. Grandoch M, Feldmann K, Gothert JR, Dick LS, Homann S, Klatt C, et al. Deficiency in lymphotoxin beta receptor protects from atherosclerosis in apoE-deficient mice. Circ Res. (2015) 116:e57–68. doi: 10.1161/CIRCRESAHA.116.305723
PubMed Abstract | CrossRef Full Text | Google Scholar
53. Guedj K, Khallou-Laschet J, Clement M, Morvan M, Gaston AT, Fornasa G, et al. M1 macrophages act as LTbetaR-independent lymphoid tissue inducer cells during atherosclerosis-related lymphoid neogenesis. Cardiovascular research. (2014) 101:434–43. doi: 10.1093/cvr/cvt263
PubMed Abstract | CrossRef Full Text | Google Scholar