26. října 2020, podle NCI Zaměstnanců
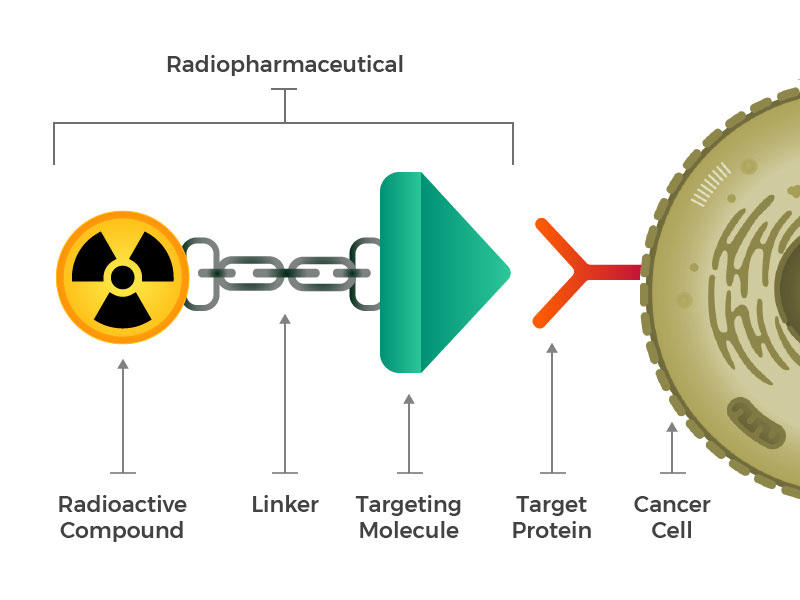
Radiofarmaka skládají z radioaktivní molekula, cílení molekuly, a linker, který spojuje dva.
poslední dvě desetiletí přinesly změnu ve způsobu léčby mnoha typů rakoviny. Cílené terapie vypínají specifické proteiny v rakovinných buňkách, které jim pomáhají růst, dělit se a šířit se. Imunoterapie stimulují nebo potlačují imunitní systém těla, aby pomohly v boji proti rakovině. Ale dlouho používané léčby-chirurgie, chemoterapie a radiační terapie-zůstávají páteří léčby většiny rakovin.
radiační terapie byla poprvé použita k léčbě rakoviny před více než 100 lety. Přibližně polovina všech pacientů s rakovinou ji stále dostává v určitém okamžiku během léčby. A až do nedávné doby, většina radiační terapie byla dána moc, jako to bylo před 100 lety, tím, že poskytuje paprsků záření mimo tělo zabít nádorů uvnitř těla.
i když je vnější záření účinné, může také způsobit vedlejší škody. I s moderním zařízením pro radiační terapii „musíte normální tkáň dostat se k nádoru,“ řekl Charles Kunos, M. D., Ph.D., programu hodnocení léčby rakoviny NCI (CTEP). Výsledná vedlejší účinky radiační terapie závisí na oblasti těla léčit, ale mohou zahrnovat ztrátu chuti, změny na kůži, vypadávání vlasů, průjem, a sexuální problémy.
nyní vědci vyvíjejí novou třídu léků zvaných radiofarmaka, které dodávají radiační terapii přímo a specificky rakovinným buňkám. V posledních několika letech došlo k explozi výzkumu a klinických studií testujících nová radiofarmaka.
Tyto studie naznačují, že zaměření radiační terapie na buněčné úrovni má potenciál ke snížení rizika a to jak krátkodobé a dlouhodobé vedlejší účinky léčby, zatímco ve stejné době umožňuje i drobné vklady rakovinné buňky bude zabit po celém těle.
„myslím, že v příštích 10 až 15 letech změní radiační onkologii,“ řekl Dr. Kunos.
stavět na přirozené afinitě
dodávat záření přímo do buněk není samo o sobě novým přístupem. Jedna taková terapie, tzv. radioaktivního jodu, se používá k léčbě některých typů rakoviny štítné žlázy od roku 1940. Jód se přirozeně se hromadí v štítné žlázy buňky. Radioaktivní verze prvku může být vyrobena v laboratoři. Při požití (jako pilulka nebo kapalina) se hromadí a zabíjí rakovinné buňky, které zbyly po operaci štítné žlázy.
podobné přírodní afinitu byl později využit k vývoji léků k léčbě rakoviny, která se rozšířila do kostí, jako je radium 223 dichlorid (Xofigo), který byl schválen v roce 2013 k léčbě metastatického karcinomu prostaty. Když rakovinné buňky rostou v kosti, způsobují, že kostní tkáň, kterou napadají, se rozpadne. Tělo se pak pokusí opravit toto poškození nahrazením této kosti-proces zvaný kostní obrat.
radioaktivní prvek radium „vypadá to, vápníku molekula, takže to bude začleněna do oblastí těla, kde kostního obratu je nejvyšší,“ jako oblasti, kde rakovina je rostoucí, Dr. Kunos vysvětlil. Radium je pak schopno zabíjet blízké rakovinné buňky.
všechny tyto radioaktivní sloučeniny cestují do rakovinných buněk bez jakékoli pomoci. Vědci přemýšleli, zda by bylo možné vytvořit nové radioaktivní molekuly, které se specificky zaměřují na jiné druhy rakoviny.
Oni představil inženýrství radiofarmaka, které se skládají ze tří hlavních stavebních bloků: radioaktivní molekula, cílení molekula (která uznává a zámky konkrétně na rakovinné buňky), a linker, který spojuje dva. Takové sloučeniny by mohly být injikovány, infuzovány, vdechovány nebo požívány a poté by se mohly dostat do krevního řečiště.
myšlenka propojení molekuly zaměřené na rakovinu s molekulou, která zabíjí rakovinné buňky, není ani nová. Například, několik léků nazývaných protilátka–lék konjugáty, ve kterém protilátka, která se váže na konkrétní nádorové buňky je spojena s toxickou drogu, byl schválen pro léčbu rakoviny.
ale úsilí o vytvoření takových léků se setkalo s omezeným úspěchem, vysvětlil Dr. Kunos, protože nestačí, aby se toxiny přiblížily rakovinné buňce. Toxiny musí být vzaty dovnitř a zůstat uvnitř buněk dostatečně dlouho, aby způsobily poškození. Mnoho rakovinných buněk má nebo vyvíjí mechanismy, které jednoduše pumpují toxiny zpět, než se to může stát.
radiofarmaka také fungují nejlépe, když se léky mohou dostat do buněk. Ale to není nutné, aby byly účinné. Jakmile se radiofarmakum přilepí na rakovinnou buňku, radioaktivní sloučenina se přirozeně rozpadá. Tento rozpad uvolňuje energii, která poškozuje DNA okolních buněk. A když je DNA buňky nenapravitelně poškozena, tato buňka zemře. Rakovinné buňky jsou zvláště citlivé na poškození DNA vyvolané zářením.
v Závislosti na typu radioaktivní sloučenina, výsledná energie může proniknout do buňky vázány radiofarmaka, stejně jako asi 10 až 30 buňky, okolní buňky. To zvyšuje počet rakovinných buněk, které mohou být usmrceny jedinou radiofarmaceutickou molekulou.
do poloviny 2010s, Food and Drug Administration (FDA) schválila dvě radiofarmaka, že cílové molekuly na některých B-buněk k léčbě některých lidí s non-Hodgkinův lymfom, typ rakoviny krve. Ale tyto léky nebyly nikdy široce přijaty. Jen málo lékařů léčících pacienty s lymfomem bylo vyškoleno k podávání těchto typů radioaktivních sloučenin. A radiofarmaka čelila konkurenci novějších, neradioaktivních léků.
hra-changer pro oblasti přišel v roce 2018, řekl Jacek Capala, Ph.d., z NCI je Záření Výzkumný Program, kdy FDA schválila lutecium Lu 177-dotatate (Lutathera) pro léčbu některých nádorových neuroendokrinních nádorů (NETs) ovlivňuje trávicí trakt.
„to ukázalo, že solidní nádory mohou být také zaměřeny tímto způsobem,“ s radiofarmakem postaveným od nuly, řekl. V tomto případě jsou cíli určité hormonální receptory, které se nacházejí v hojnosti na povrchu čistých buněk.
Lutecium Lu 177-dotatát byl lepší při zpomalení čistého růstu než jakýkoli předchozí testovaný lék, vysvětlil Aman Chauhan, MD, z University of Kentucky, který vede několik nových klinických studií léku. „Pro náš obor to byl obrovský krok vpřed,“ řekl.
Přizpůsobení Léky ze Zobrazovací Sloučeniny
Vědci jsou nyní navrhování a testování radiofarmak pro řadu druhů rakoviny, jak různorodý jako melanom, rakovina plic, rakovina tlustého střeva, rakovina a leukémie, řekl Dr. Capala. Jakýkoli nádor, který má na povrchu svých buněk cílenou molekulu a dobrý přísun krve-dostatečný k dodání léků-by mohl být potenciálně léčen radiofarmaky, dodal Dr. Chauhan.
mnoho z těchto novějších léčiv jsou přepracované verze existujících sloučenin používaných pro jaderné zobrazování. Nukleární zobrazovací testy, jako je pozitronová emisní tomografie (PET), někdy používají slabě radioaktivní sloučeniny spojené s molekuly, které se vážou na specifická místa na povrchu nádorových buněk. Specializované kamery pak mohou odhalit i drobná ložiska rakovinných buněk, což pomáhá měřit šíření rakoviny tělem.
výzkumníci nyní repurposed tyto cílení molekuly nést silnější radioaktivní sloučeniny, nebo izotopy, místo toho-ty—které by mohly zabíjet rakovinné buňky namísto jednoduše pomáhá vizualizovat.
rakovina prostaty byla časným testovacím místem pro toto opětovné použití. Protein zvaný PSMA se nachází ve velkém množství – a téměř výhradně-na buňkách prostaty. Sloučením molekula, která se váže na PSMA na radioaktivní směs, která se používá v PET skenování imaging, vědci byli schopni představit malé vklady rakoviny prostaty, které jsou příliš malé, aby být detekována pomocí konvenčních zobrazovacích.
několik radiofarmak, které se zaměřují na PSMA, je nyní testováno v klinických studiích.
Většina rakoviny prostaty jsou velmi citlivé na záření, a vnější záření se běžně používá k léčbě onemocnění, vysvětlil Frank Lin, M. D., NCI Centrum pro Výzkum Rakoviny, která je vedoucí klinického hodnocení jednoho PSMA-cílení radiofarmaka v NIH Klinické Centrum.
většina mužů, kteří dostávají záření jako jejich počáteční léčba nebude mít recidivu jejich rakoviny. Ale pokud ano, někdy se šíří po celém těle, s mnoha malými ložisky rakovinných buněk v mnoha orgánech, vysvětlil.
„Když se nádor šíří jako, že nemůžete opravdu udělat externí ozařování, protože vnější záření může být zaměřena na a léčit malou část vašeho těla v době,“ Doktor řekl Lin.
S radiofarmaka, která se zaměřuje PSMA je lepší způsob, jak dát záření v těchto případech, protože to může být aplikován přímo do krevního oběhu a šíří se široce, připojení na buňky rakoviny prostaty, které se šíří po celém těle, vysvětlil.
a velkou výhodou zobrazovacích a léčebných molekul, které používají stejný cíl, je to, že zobrazování může lékařům poskytnout náhled na to,zda léčba pravděpodobně bude fungovat, dodal Dr. Lin.
například ve studii Dr. Linové musí muži před léčbou podstoupit pet sken s zobrazovací verzí sloučeniny. Pokud zobrazovací sloučenina najde cestu do nádorových buněk a je detekováno na PET skenu, pak vědci mohou předpokládat, že odpovídající radiofarmaka léčba zasáhne svůj cíl.
„tento doplňkový vývoj diagnostiky ruku v ruce s farmakoterapií činí toto pole mnohem více vzrušující,“ řekl Dr. Chauhan. „Tímto způsobem můžeme vědět, že dodáváme terapii přímo do nádorových buněk.“
Stěhování do Kombinace Terapie
Zatímco radiofarmaka ukázaly, slib, že na začátku studie, oni jsou také, stejně jako je tomu u jiných typů rakoviny léky, je nepravděpodobné, že zničit nádor na jejich vlastní.
například, lutecium Lu 177-dotatate více než zdvojnásobil počet lidí, kteří měli jejich neuroendokrinní nádory zmenšovat po léčbě, ale to číslo bylo ještě skromný: o 17% oproti 7% bez drog, vysvětlil Dr. Chauhan.
„stále existuje významný prostor pro zlepšení,“ řekl.
použití radiofarmak v kombinaci s jinými terapiemi může být jedním ze způsobů, jak dosáhnout tohoto zlepšení. Někteří vědci jsou nyní testování radiofarmak v kombinaci s radiační senzibilátory—léky, které nádorové buňky ještě více citlivé na záření. Například, Dr. Chauhan vede klinické studii lutecium Lu 177-dotatate v kombinaci s radiační senzibilátor nazývá triapine, které bloky buněk produkujících sloučeniny potřebné pro opravy DNA po zářením-indukované poškození.
v jiné studii Dr. Lin testuje Lutecium Lu 177-dotatát s typem léku nazývaného inhibitor PARP. Tyto léky, které jsou již schváleny k léčbě některých typů rakoviny prsu, vaječníků a dalších rakovin, blokují samotný proces opravy DNA. „Takže záření by způsobilo poškození DNA a inhibitor PARP by zabránil nádorovým buňkám v hojení jejich DNA po záření,“ vysvětlil.
jiní vědci kombinují radiofarmaka s imunoterapiemi, aby se pokusili zvýšit účinnost těchto léků. „Nedávné studie ukázaly, že radiofarmaka mohou vytvořit nádory více citlivé na imunoterapii,“ řekl Dr. Capala.
Mnoho nádorů jsou „studené“ nádory, vysvětlil, že imunitní buňky je neuznávají, nebo nefungují správně v mikroprostředí kolem nádorů, vysvětlil.
Ale když záření zabíjí rakovinné buňky, bílkoviny a DNA z těchto buněk může rozlít do krevního oběhu, imunitní buňky, aby zjistili, které mohou umožnit buňky imunitního systému rozpoznat a zabít ostatní nádorové buňky v celém těle. Radiační terapie může také učinit mikroprostředí nádoru pohostinnějším pro imunitní buňky, dodal Dr. Capala.
společně mohou tyto účinky změnit studený nádor na“ horký “ nádor: ten, který má hojnost imunitních buněk a může reagovat na imunoterapeutické léky. Některé studie se pokusily použít vnější záření k vytvoření tohoto druhu reakce.
“ ale existují údaje, které naznačují, že funguje lépe, pokud je každý nádor, každá metastáza, vystaven záření. Takže radiofarmaka terapie má výhodu tu, že jakmile je to v těle dosáhne všech metastáz,“ Dr. Capala vysvětlil.
může mít dokonce smysl kombinovat radiofarmaka s vnějším zářením, pokud pečlivé plánování léčby může zajistit bezpečnou celkovou dávku záření, dodal Dr. Capala. „Vnější radiační terapie je velmi dobré cílení na velké nádory, a pak můžete kombinovat s radiofarmaka terapie cíl metastáz,“ řekl.
výzvy a varování
oblast radiofarmak je stále v počátcích. Jednou z výzev, kterou bude muset přístup překonat, než bude moci být používán ve větší míře, je nedostatek lékařů vyškolených k podávání takových léků.
„počet lékařů nukleární medicíny v USA je malý,“ řekl Dr. Lin, který má výcvik v nukleární medicíně i lékařské onkologii. „A myslím, že trénujeme jen 70 nebo 80 nových lidí ročně.“
Tak daleko, tento nedostatek pracovní síly má stále radiofarmaka od žít svůj skutečný potenciál jako osobní léčbu, vysvětlil Dr. Capala. Že potenciál odráží skutečnost, že, na rozdíl od jiných typů rakoviny, léky, lékaři mohou používat zobrazovací přesně změřit, kolik radiofarmaka dosáhl nádor, téměř v reálném čase, a upravit dávku odpovídajícím způsobem.
Ale tento typ plánování léčby vyžaduje multidisciplinární znalosti, které nejsou běžně dostupné a nechal lidi pomocí radiofarmak více jako „radioaktivní chemoterapie,“ s jeden-velikost-fits-všechny dávky, dodal. „To znamená, že mnoho pacientů nedostává optimální léčbu,“ řekl Dr. Capala.
jsou také zapotřebí dlouhodobé studie bezpečnosti, dodal Dr. Chauhan. Lidé léčeni externí radiační terapií mohou zaznamenat některé nežádoucí účinky, nazývané pozdní účinky—jako je vývoj druhých rakovin-měsíce nebo roky po léčbě. Přestože dosavadní výzkum neprokázal vysokou míru pozdních účinků radiofarmaceutické léčby, “ jedná se o velmi nové látky a musíme být i nadále opatrní a sledovat je,“ řekl.
Vyhlazení Spolupráce
Protože tyto léky jsou relativně nové, a to i s pokusy probíhají, „jsme jen poškrábání povrch to, vývoje léčiv pro radiofarmaka,“ Dr. Chauhan řekl.
V roce 2019, dále zvýšit hodnocení ze slibných nových radiofarmak, NCI zahájila Radiofarmaka Rozvoj Iniciativy (VAVPI) k urychlení slibných nových léků do klinické testování.
Jedna věc NCI doufá, že k dosažení s RDI, je makléř více pokusů s využitím kombinace léků vyráběných různými farmaceutickými společnostmi, které nemusí spolupracovat jinak, vysvětlil Dr. Kunos, který vede iniciativu. Obavy z duševního vlastnictví a nedostatek důvěry mohou takové projekty zastavit dříve, než začnou, vysvětlil Dr. Kunos.
„tyto typy spolupráce by se nutně nestaly, pokud by NCI nebyl čestným makléřem uprostřed,“ řekl. Právě teď pouze asi 2% raných fází studií podporovaných NCI testuje radiofarmaka, ale s RDI to může v nadcházejících letech exponenciálně růst, dodal.
„nebudeme eliminovat stroje nebo jiné techniky, které používáme při radiační terapii,“ řekl Dr. Kunos. „Ale s jejich cílenou povahou si myslíme, že radiofarmaka změní způsob, jakým používáme záření.“