Kalmodulin
Toto je video úvod do vápníkové signalizace protein kalmodulin, z anorganický chemik pohledu!
Calmodulin nebo CaM je polypeptid, který je všudypřítomný ve všech eukaryotických buňkách. Tento protein je známý jako kalmodulin, protože se jedná o protein modulovaný vápníkem, který hraje zásadní roli v procesu transdukce signálu vápníku. Transdukce signálu vápníku je proces, kterým interakce mezi ionty vápníku a četnými proteiny zprostředkovávají komunikaci mezi buňkami. funkce kalmodulinu je proto nezbytná ve všech eukaryotických buňkách a některé z úkolů, které pomáhá dosáhnout, jsou nervová signalizace, pohyb kosterního svalstva a paměť. Snímání vápenatých iontů v prostředí, aktivuje kalmodulin a následně působí jako meziprodukt, zahájení závazné důležitých proteinů, jako jsou kinázy, které pomáhají naše buňky v základní a sofistikované funkce („Kalmodulin“).
video níže ukazuje strukturální změny, ke kterým dochází v CaM během vazby vápníku (PDB kódy 3CLN a 1CFD).
protein je sám o sobě 148 aminokyselin v délce dvou kulových regionů obsahující 2 EF-hand motivy každého, které jsou charakteristické stránky vápníku-zprostředkované polypeptidy. Při aktivaci obsahuje kalmodulin 4 ionty Ca2+, které drasticky mění tvar proteinu. Když se kalmodulin váže s ionty vápníku, protein se otevírá ze své apo formy do své halo formy a vystavuje alfa šroubovice, která je známá jako oblast spojovacího nebo centrálního postroje. Razil pro jeho flexibilitu, centrální tether regionu je umístění bílkovin, na které partner vázat proteiny a přispívají k cascade, že je sekundární messaging vápníku. Na základě své struktury a potřeby funkce iontů vápníku musí být kalmodulin schopen vybrat ionty vápníku v cytoplazmě a interakce mezi iontem a ligandy v doménách EF podporují tuto myšlenku selektivity (Bertini et. Ala., 635-638).
tento obrázek je zobrazením toho, jak se motiv EF-ruky podobá ruce. Stuha diagram vlevo ukazuje jeden ze čtyř charakteristických helix-turn-helix EF ruku motivy kalmodulin. (PDB kód 3CLN)
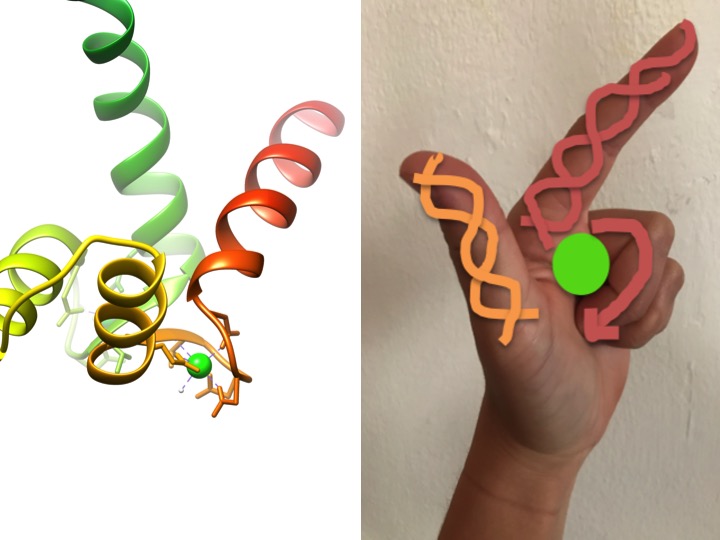
EF-ruční motivy jsou vysoce konzervované strukturní oblasti proteinů podílejících se na vazbě vápníku. Tyto regiony jsou známé jako „ruka“ motivy protože oni se podobají ruce, který je vyroben ve tvaru L, kde je kovový ion se nachází ve středu pěst, alfa šroubovice, jsou označeny nahoru-ukazuje ukazováček a dovnitř směřující palec, a kroutil prsty představují zapnout nebo loop regionu. To je ukázáno na obrázku výše. V charakteristické EF-hand motiv, aminokyseliny včetně glutamáty, asparagines, asparagové kyseliny a glutamové kyseliny se váží na Ca, stejně jako voda (Bertini et. Ala. 639). Typická sekvence vazby domény EF-hand je znázorněna na obrázku níže.
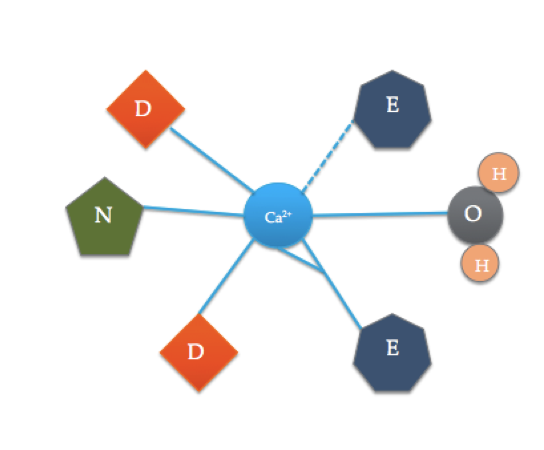
tato karikatura ilustruje koordinované aminokyseliny v typické doméně EF (přesné složení aminokyselin se liší!). Přerušovaná čára představuje koordinaci Ca s kyslíkem páteřního karbonylu, zatímco pevné čáry označují koordinaci bočních řetězců nebo vody.
kalmodulin vazebné místo je poněkud jiný, než většina typických EF hand domény je uvedeno výše. 6 ligandy kalmodulin patří postranních řetězců tři asparatic kyselin (D), 1 kyselinu glutamovou (E), která tvoří dvě koordinovat kovalentní vazby s ion, 1 molekuly vody z roztoku a 1 molekulu karbonylové od páteře. Vazebné místo kalmodulinu sestává z iontu Ca2+ obklopeného 6 ligandy při vytváření 7 vazeb.
lze si všimnout, že motiv EF v kalmodulinu obsahuje mnoho stejných ligandů, jen na různých místech. Tato konformace může poskytnout představu o tom, proč je kalmodulin selektivní pro vápník a jak pouze přítomnost iontu vápníku může uspokojit vazebné místo, které způsobuje aktivaci proteinu. To souvisí s termodynamikou kalmodulinu v buňce a tím, jak reaguje na přítomnost iontů vápníku.
pochopit, termodynamika, že páry, aktivace kalmodulin, jeden musí nejprve pochopit, koncentrace iontů, jako je vápník a hořčík v rámci eukaryotických buněk, včetně lidských. Koncentrace těchto iontů musí být pečlivě regulována. V buňce je signalizace vápníku doprovázena dočasným zvýšením koncentrace iontů vápníku, které jsou snímány bílkovinami, jako je kalmodulin (Bertini et. Ala., 636). Tento nárůst vápníku může být způsoben intracelulárními G-proteiny, které indukují hrubé a hladké retikulum k uvolnění vápníku, nebo ionty vápníku mohou být přivedeny z extracelulárního prostoru. V případě, kalmodulin, to je obvykle reagují na vápník přinesen do buňky zvenčí, ke kterému dochází během procesů, jako jsou nervové signalizaci (Bertini et. Ala. 637). Předtím, než je koncentrace vápníku na okamžik zvýšena, je koncentrace v buňce obvykle mezi 10-100 nm, zatímco během krátkého přílivu iontů se koncentrace zvyšuje na 1 000-100 000 nm. Změna koncentrace způsobuje, že kalmodulin snímá ionty vápníku, váže je a iniciuje další přenos signálu (Bertini et. Ala., 635).
Jak tedy kalmodulin definitivně váže ionty vápníku a ne například ionty hořčíku? Ionty Mg2+ jsou ve skutečnosti velmi podobné iontům vápníku: zapojily by se spíše do elektrostatických interakcí než kovalentní, a jsou považovány za tvrdé atomy. Důvod, že kalmodulin zdá se, nakloněn ionty vápníku, spíše než ionty hořčíku souvisí vazebných konstant jednotlivých iontů. Kalmodulin může existovat zároveň povinen jiných iontů, jako je například hořčík, ale pokud je vyšší koncentrace vápníku, ionty vápníku, bude ihned soutěží z hořčíku ionty zabírají vápník-vazebná místa. Je to proto, že vazebná konstanta CaM a Ca2+ (Ka) je větší než konstanta CaM a Mg2+, jak je znázorněno na obrázku 7. To naznačuje, že při navázání na ionty vápníku by kalmodulin produkoval více produktů. Člověk musí zvážit všechny tyto myšlenky udržet v paměti, že tento proces se stane nespočet krát za sekundu, a obrat tohoto proteinu změny v reakci na někdy-modulovaný koncentrace vápníku z buňky.
proč je vazba kalmodulinu s ionty vápníku příznivější než u jiných kovů? Mohlo by to být kvůli velikosti iontů ve vztahu k sterické překážce indukované ligandy. Vazebné místo je charakterizováno 6 ligandy vytvářejícími 7 souřadnicových vazeb. Protože vápenaté ionty jsou větší než ionty hořčíku, jak je ukázáno na Obrázku 8, je možné, že vápník je výhodné, protože to zvyšuje vzdálenost ligandů se od sebe navzájem, a proto snižuje stérické interakce mezi ligandy. Samotná struktura samotného proteinu by také mohla představovat důvod pro selektivitu iontů vápníku. Celkově je známo, že díky termodynamice založené na různé buněčné koncentraci iontů vápníku bude kalmodulin cítit nárůst iontů, vázat je a pomáhat plnit jeho funkci.
CaM + Ca2+ <–> Ca2+CaM (KCaM-Ca)
CaM + Mg2+ <–> Mg2+CaM (KCaM-Mg)
Mg2+-CaM + Ca2+ <–> Ca2+CaM + Mg2+
protože KCaM-Ca > KCaM-Mg
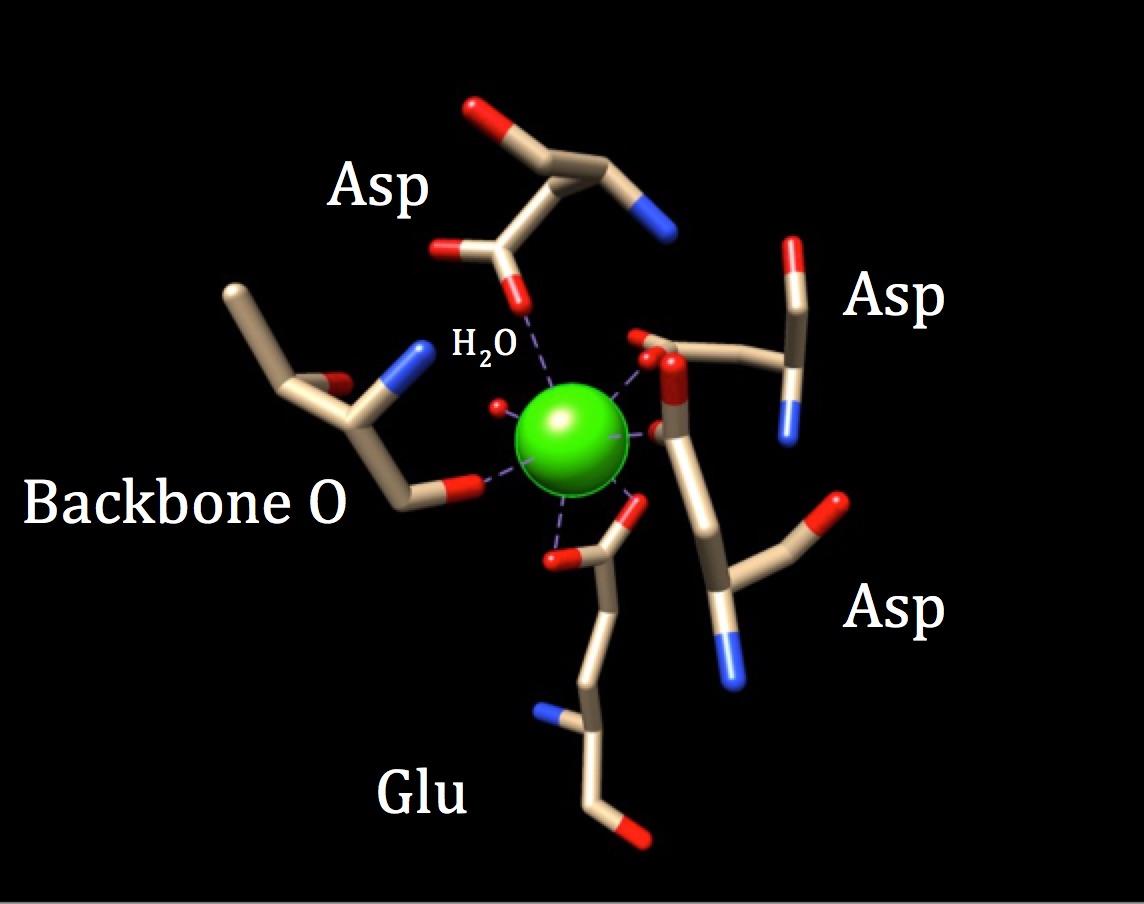
V další diskusi z chemie vazebné místo pro kalmodulin, koordinační geometrie by měly být prozkoumány. Protože iont vápníku interaguje se sedmi donorovými atomy, systém je známý jako heptadentátový systém. Protože je kalmodulin obklopen šesti ligandy, předpokládá se osmistěnová koordinační geometrie. Ale, protože jeden z ligandů spolupracuje v dvojvazný módy s ion—což znamená, že to má dvě koordinovat kovalentní vazby pocházející z různých atomů v jedné aminokyseliny—koordinační komplex trvá na zkreslené oktaedrická tvar. Konkrétní koordinace je uvedena na obrázku níže.
koordinační geometrie kalmodulinového vazebného místa na vápník. Centrum iontu vápenatého kovu je obklopeno třemi asparaginy (Asp), jedním páteřním kyslíkem, jednou gluatmovou kyselinou (Glu) a jednou molekulou vody. (PDB kód 3CLN)
můžeme se také odkazovat na teorii chelát vliv na lepší pochopení možností kalmodulin vázat ionty kovů s vysokou afinitou. Chelátor je atom, který je schopen se vázat s více než jedním atomem dárce. Polydentate lepení souvisí s chelát efekt, který uvádí, že při ligand se váže s mnoha dárcovských skupin (poly), koordinovat kovalentní vazby jsou mnohem silnější, nebo více pevně držel. Tato teorie je podpořena termodynamiky, konkrétně, že polydentate závazné zvýšení entropie systému, což je více pozitivní (další porucha), což je termodynamicky příznivé. Aplikace této teorie na kalmodulin pomáhá vysvětlit nejen význam polydendate lepení v místech samotných, ale také třeba pro protein vázat 4 různé ionty vápníku pro aktivaci funkce. V podstatě vyžaduje, lepení čtyř Ca2+ iontů do míst, systém podporuje nárůst entropie zavedením více substráty/reaktanty tvořit větší počet výrobků. K tomu dochází v důsledku vyššího počtu vazeb uvnitř ligandových interakcí každého vazebného místa. Celkově vzato, vazba vápenatého iontu v místech polypeptidu je podporována teorií chelátového účinku a vrhá světlo na účinnost kalmodulinu ve vazbě vápníku.
EF-ruční motivy mají určitou strukturu založenou na skutečnosti, že vápník je centrální kov. To platí také pro místa vázající kalmodulin. Ion Ca2+ se váže s podobnými atomy ve strukturách určitých aminokyselin na základě teorie zvané tvrdá / měkká acidobazická teorie. Tato teorie rozděluje kovy a ligandy do dvou kategorií na základě polarizovatelnosti a poměru jejich náboje k poloměru. Tvrdé kyseliny a zásady jsou menší ionty, které mají větší náboj velikosti poměru, a to vede k interakci v elektrostatickém způsoby (což znamená, atrakce, mezi + a – poplatky), vzhledem k tomu, že měkké kyseliny a báze jsou větší a mají proto menší poplatek poloměr poměr, vede je, aby se dluhopisy s kovalentní charakter. Fráze „jako se váže s podobně“ odkazuje na skutečnost, že tvrdé kyseliny a zásady mají tendenci interagovat s jinými tvrdými atomy, a totéž platí pro měkké kyseliny a zásady. Ca2+ je charakterizován jako tvrdá kyselina, protože i když má velký poloměr, interaguje s ligandy převážně elektrostatickým způsobem. Při pohledu na vápník-vazebné místo pro kalmodulin, jeden může vidět, že vápenatých iontů váže na atomy kyslíku 3 asparagové kyseliny, kyselina glutamová, vody, a páteř karbonylu. Tato vazba je v souladu s „líbí se váže s podobně“, protože voda a aminokyseliny ligandy, kyselina glutamová a asparatic kyseliny, vážou přes kyslík dárců, které jsou charakterizovány jako tvrdé základy. Obrázek 10 přepracovala vazebná místa pro kalmodulin a zároveň ukazuje negativní sidechains z aminokyselin, které by v interakci s ionty vápníku označený v modré barvě.
O dárce atomy vázány ligandy a jejich schopnost darovat elektronové páry koordinační komplex, spectrochemical série vysvětluje, jak atomy interagují s centrální kov. V případě místa vázajícího vápník jsou kyslíky, které interagují s iontem Ca2+, považovány za σ dárce a π dárce, protože dárcovské kyslíky mají 2 nebo více párů elektronů. Kategorie spectrochemical seires, které určují elektronové dostupnost a dar mít dopad na spin označení (nízká nebo vysoká), která určuje, jak d elektrony vyplnit jejich orbitaly, a delta (Δ) velikost mezi kovovými d-orbitaly, ale to neznamená, že rozdíl pro vápník, protože vápník je d orbitaly jsou neobsazené vzhledem k absenci valence d elektrony. Díky tomu jsou D orbitaly ve většině rozhovorů týkajících se proteinu v podstatě zanedbatelné. Jedna výjimka souvisí s ohledem na labilitu vápenatého iontu v systému.
nedostatek elektronů v D orbitálech Ca poskytuje nulovou stabilizační energii ligandového pole a vysvětluje vysokou labilitu iontu vápníku. Labilita označuje rychlost, jakou mohou být ligandy nahrazeny v koordinačních komplexech, a proto popisuje kinetiku systému. Atomy jsou labilní, pokud si rychle vyměňují ligandy. Protože jeho relevantní funkce ve všech eukaryotických buněk, kalmodulin se očekává, že vázat a uvolňovat ionty vápníku miliony krát za sekundu, aby bylo možné odesílat a přijímat zprávy od okolních buněk prostřednictvím přenosu iontů vápníku. Pokud jde o schopnost kalmodulinu vázat a uvolňovat Ca2+ rychle, je důležité zvážit obsazení valenčních d elektronových orbitalů. Jak bylo uvedeno, vápník má prázdné valenční d orbitaly. Tyto neobsazené orbitaly mohou vést k vysvětlení lability iontu Ca2+. Protože všechny d orbitaly vápenatého iontu jsou prázdné, má stabilizační energii ligandového pole (LFSE) 0. To znamená, že vápník je nestabilní při zvažování LFSE vzhledem k tomu, že stabilní molekuly mají obvykle negativní hodnotu pro LFSE. Nestabilita se v tomto případě promítá do ochoty rychle reagovat a pohybovat se dál a mimo komplexy, což podporuje tvrzení, že ionty Ca2+ podporují rychlé reakce a lze je charakterizovat jako labilní. I když se to zdá být kontraintuitivní k diskusi zahrnující chelátový efekt, rozumí se, že tyto dvě teorie si navzájem neodporují. Stabilita pevně držel koordinace dluhopisů, který je navrhl chelát efekt podporuje kalmodulin zůstat stabilní, dostatečně dlouhé, aby svázat doplnit bílkoviny. Jakmile je dokončena a koncentrace vápníku se vrátí do normálu,je účinná při odstraňování místa iontů vápníku.
Kalmodulin, na základě jeho struktury a složení jeho zásadní lepení místě, hraje nedílnou součástí nesčetné procesy prováděné eukaryotických buněk. Prostřednictvím přijímání a vazby iontů vápníku v signální transdukci působí kalmodulin jako klíčová složka základního a vysokého fungování v organismech, jako jsou lidé. Použitím bioanorganická teorie uchopení a pochopení pečlivě monitorovaném prostředí eukaryotické buňky, lze správně pochopit schopnost kalmodulin vybrat pro ionty vápníku a podpořit další fungování zahrnující více než 100 partnerských proteinů.