tento příspěvek přispěl Kurt Thorn z Nikon Imaging Center na UCSF.
společný požadavek pro live cell imaging experimentů je schopnost sledovat více fluorescenčně označených druhů současně. K tomu, aby s fluorescenční protein štítky vyžaduje více fluorescenčních proteinů, jejichž excitační a emisní spektra se liší dostatečně pro ně být zobrazen v různých fluorescenčních kanálů na mikroskopu. S šířením fluorescenční proteiny v posledních letech, existuje mnoho fluorescenční protein kombinací, které může být zachycen spolu, ale to také znamená, že volba fluorescenční proteiny vyžaduje trochu přemýšlení.

prvním krokem při výběru fluorescenčních proteinů pro váš vícebarevný zobrazovací experiment je uvědomit si, jaké fluorescenční proteiny jsou k dispozici. S novými fluorescenčními proteiny zveřejňovanými každý měsíc je rozhodování o nejlepším proteinu pro danou aplikaci výzvou. Abychom vám pomohli držet krok s nejnovějšími fluorescenčními proteiny, udržuji interaktivní graf a tabulku nejlepších fluorescenčních proteinů, které jsou v současné době k dispozici.
Výběr kompatibilních fluorescenční proteiny
zvolit sadu fluorescenční proteiny, které mají být zobrazen společně, budete muset zvážit, stejné faktory jako při výběru jednotlivých fluorescenční protein (jas, fotostabilita, a tak dále; viz předchozí blog post pro další diskusi o těchto faktorech). Kromě toho budete také muset vybrat fluorescenční proteiny, které lze od sebe odlišit a které lze zobrazit optikou na mikroskopu(mikroskopech), které chcete použít. Přesné stanovení, zda dva fluorescenční proteiny mohou být odděleny od sebe navzájem, vyžaduje znalost jejich excitační a emisní spektra, ale dobré pravidlo je, že obě vrcholu excitační vlnové délky a maximální emisní vlnové délce dva proteiny by měly být odděleny 50-60 nm. Například, SRP (ex 430 nm / em 474 nm) a YFP (ex 514 nm / em 527 nm) může být zachycen spolu, ale SRP a GFP (ex 488 nm / em 507 nm) ukázat některé přeslechy mezi dva fluorescenční proteiny. Pokud si musíte představit fluorescenční proteiny, jejichž spektra se překrývají, existují techniky, jako spektrální unmixing, které lze použít k oddělení fluorescenčních proteinů, ale ty jsou nad rámec tohoto příspěvku.
jsou vaše fluorescenční proteiny kompatibilní s optikou mikroskopu?
K určení, zda fluorescenční proteiny mají zájem, jsou kompatibilní s vybraným mikroskop optika, budete chtít porovnat excitačních a emisních spekter bílkovin s filtrem nastaví nebo lasery na váš mikroskop. V ideálním případě byste chtěli mít značné překrývání mezi excitační a emisní filtry a excitačních a emisních spekter bílkovin, takže protein je dobře nadšený tím, že váš mikroskop a fluorescenční emisní proteinu je efektivně shromážděné mikroskopem. Pro porovnání shody mezi fluorescenčním proteinem a sadou filtrů poskytuje mnoho dodavatelů sady filtrů nástroje pro vykreslení fluorescenčních spekter proteinů a barviv a jejich filtrů(viz Chroma, Semrock nebo Omega). I když tyto neobsahují všechny fluorescenční proteiny, které se běžně používají (zejména ne ty nedávno publikované), mohou být dobrým výchozím bodem. V mnoha případech stačí použít spektrum pro úzce související protein, pokud víte, že váš protein zájmu má podobné spektrum. Například, tady je screenshot z Chroma Spectra Viewer srovnání standardní Cy3 nebo Rhodamine sada filtrů (Chroma #49004) spekter obou mCherry a TagRFP.
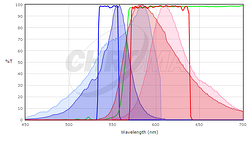
zde je spektrum TagRFP zobrazeno v tmavších barvách a spektrum mCherry je zobrazeno ve světlejších barvách; excitační spektra jsou modrá a emisní spektra jsou červená. Ani je perfektní zápas pro filtr nastavit, ale excitační filtr vzrušuje víc vrcholu TagRFP excitační a emisní filtr shromažďuje větší zlomek TagRFP emisí než mCherry emisí. U této sady filtrů bychom očekávali, že TagRFP dá jasnější signál než mCherry. Obecně platí, že filtr soupravy určené pro Rhodamine / Cy3 bude lépe pracovat s kratší vlnovou délku červené fluorescenční proteiny jako TagRFP nebo mRuby2 než delší vlnové délce proteiny jako mCherry. Pro pozadí na fluorescenční a filtrační sady, viz úvod do fluorescenční mikroskopie přednáška na iBiology.
Běžně používané filtrační sady & příslušné fluorescenční proteiny
Běžně používané filtrační sady pro barevné zobrazování zahrnují ty, určené pro CFP, YFP, RFP a nebo Sedat Quad filtr, určený pro DAPI / Fluorescenční / Rhodamine / Cy5 (např. Semrock) a podobné 4-laser kombinace na konfokálním (405 / 488 / 561 / 640 nm). V našich rukou nejlepší fluorescenční proteiny pro zobrazování s touto sadou jsou mTagBFP2, EGFP nebo jeden z vylepšené varianty GFP, mRuby2 nebo TagRFP-T, a infračervené fluorescenční protein jako iFP1.4 nebo iFP2.0. Mějte na paměti, že tyto infračervené fluorescenční proteiny vyžadují biliverdin jako kofaktor, takže možná budete muset doplnit své buňky biliverdinem pro maximální jas. V savčích buňkách, jeden z vylepšené skládací variant EGFP jako mEmerald nebo Jetel je asi nejlepší; mNeonGreen je ještě novější zelený fluorescenční protein, který by měl být velmi jasné. V S. cerevisiae, Testovali jsme řadu zelených a červených fluorescenčních proteinů s touto sadou filtrů a hlásili jsme měření jasu. Zde EGFP překonává vylepšené varianty skládání, pravděpodobně kvůli nižší teplotě růstu. To také naznačuje, nicméně, že neexistuje jediný fluorescenční protein optimální pro všechny organismy a že pokud chcete, nejjasnější signál, budete muset vyzkoušet několik proteinů ve vašem systému zájmů. Konečně, v této sadě proteiny, zelené a červené proteiny jsou obecně nejvíce zjistitelné a proto by měly být používány označte nejméně hojné proteiny, s modré a infračervené kanály používané pro hojnější proteiny nebo označení jednotek.
doufám, že to vrhá nějaké světlo na vícebarevné zobrazování pomocí fluorescenčních proteinů. Se správným mikroskopem a správnou volbou fluorescenčních proteinů by zobrazování čtyř barev současně mělo být docela jednoduché.
děkujeme našemu hostujícímu blogerovi!
 Kurt Thorn je docentem na UCSF, kde řídí Nikon Imaging Center. Doktorát z biofyziky získal na UCSF v laboratoři Ronalda Vale, poté působil v Bauerově Centru pro výzkum genomiky na Harvardově univerzitě. Více se dozvíte na jeho webové stránce laboratoře nebo na blogu mikroskopie.
Kurt Thorn je docentem na UCSF, kde řídí Nikon Imaging Center. Doktorát z biofyziky získal na UCSF v laboratoři Ronalda Vale, poté působil v Bauerově Centru pro výzkum genomiky na Harvardově univerzitě. Více se dozvíte na jeho webové stránce laboratoře nebo na blogu mikroskopie.