Die Verwendung eines Azofarbstoffs als Indikator – Methylorange
Azoverbindungen enthalten ein stark delokalisiertes Elektronensystem, das sowohl Benzolringe als auch die beiden Stickstoffatome, die die Ringe überbrücken, aufnimmt. Die Delokalisierung kann sich auch auf Dinge erstrecken, die an den Benzolringen befestigt sind. Wenn weißes Licht auf eines dieser Moleküle fällt, werden einige Wellenlängen von diesen delokalisierten Elektronen absorbiert. Die Farbe, die Sie sehen, ist das Ergebnis der nicht absorbierten Wellenlängen. Die Gruppen, die zur Delokalisierung (und damit zur Absorption von Licht) beitragen, werden als Chromophor bezeichnet.
Die Modifizierung der im Molekül vorhandenen Gruppen kann sich auf das absorbierte Licht und damit auf die Farbe auswirken, die Sie sehen. Sie können dies in Indikatoren nutzen. Methylorange ist ein Azofarbstoff, der je nach pH-Wert in zwei Formen vorliegt:
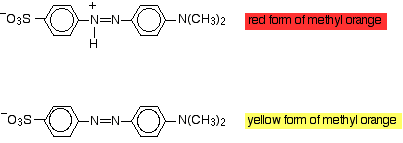
Wenn das Wasserstoffion verloren geht oder gewonnen wird, ändert sich die genaue Art der Delokalisierung im Molekül, und dies führt zu einer Verschiebung der Wellenlänge des absorbierten Lichts. Das bedeutet natürlich, dass Sie eine andere Farbe sehen. Wenn Methylorange hinzugefügt wird, bindet sich ein Wasserstoffion, um die rote Form zu erhalten. Methylorange ist in sauren Lösungen rot (tatsächlich Lösungen mit einem pH-Wert von weniger als 3,1). Wenn ein Alkali zugegeben wird oder Wasserstoffionen entfernt werden, dann wird die gelbe Form erzeugt. Methylorange ist bei pH-Werten größer als 4,4 gelb.
Dazwischen wird es irgendwann gleiche Mengen der roten und gelben Formen geben und so sieht Methylorange orange aus.