Dimethyl Sulfoxide Oxidations
Dimethyl sulfoxide-based oxidation of primary alcohols to aldehydes or secondary alcohols to ketones is a mild method that does not depend upon heavy metal oxidants. Here is a brief, chronological history of the procedure.
Index:
-
Swern Oxidation (trifluoroacetic anhydride)
-
Swern Oxidation (oxalyl chloride)
Kornblum Oxidation: (1959) A primary tosylate is heated at 150o to cause SN2 displacement by the oxygen of dimethyl sulfoxide (DMSO) in the presence of NaHCO3. O mecanismo aceito na época era uma eliminação E2 como mostrado. Sulfeto de dimetilo (DMS) é o produto de redução da reação. This work formed the tosylate from the alkyl iodide with silver tosylate. Presumivelmente o tosilato pode ser preparado a partir do álcool que é uma rota mais direta. A desvantagem do procedimento é a temperatura elevada, embora o tempo de contato é apenas alguns minutos. A questão essencial é encontrar um método para gerar o sal de sulfato.

Barton Modification: (1964) Barton and coworkers were able to generate sulfenate salts by treating alkyl clorofformates with DMSO with loss of CO2. A adição de trietilamina gera o produto de oxidação. Este procedimento melhorou as condições duras do procedimento de Kornblum. Além disso, o clorofórmio está prontamente disponível por tratamento do álcool a ser oxidado com excesso de fosgénio.

Oxidação Moffatt-Pfitzner: (1963) This variant of a dimethyl sulfoxide-based oxidation was developed at Syntex. O ativador é preparado por protonação de diciclohexil carbodiimida (1, DCC), que é atacado por sulfóxido de dimetilo. Intermediate 2 is again protonated to facilitate addition of the alcohol oxygen on the sulfur atom. A 4 diciclohexil ureia estável é formada juntamente com o sal de sulfato 3. Esta espécie sofre colapso no composto carbonilo sob a influência do anião di-hidrogenofosfato. Embora o ácido fosfórico seja um catalisador ácido eficaz para esta reação, ácido sulfúrico, cloreto de hidrogênio e ácido trifluoroacético não são. No entanto, trifluoroacetato de piridínio é um catalisador eficaz. É fundamental que a base conjugada do ácido seja básica o suficiente para efetuar o último passo da reação.

mecanismo de Torrsell: (1966) o químico sueco Torrsell demonstrou que o mecanismo destas oxidações à base de DMSO não procede através de uma eliminação-β intermolecular. A eliminação é um processo intramolecular. O sal de sulfato 5 foi preparado pelo procedimento de Moffatt-Pfitzner (ver acima). Se o mecanismo de Kornblum fosse aplicado, o sulfeto de dimetilo obtido seria desprovido de Deutério (Experimento 1). Contudo, foi obtido sulfureto de dimetilo-d1 (7). This result is consistent with a base that desprotonates the methyl group attached to sulfur forming ylid 6. O ilid decompõe-se por desprotonação intramolecular para produzir os produtos observados.Experiência 1:

para corroborar este mecanismo, o deutério foi incorporado no DMSO como DMSO-d6. Consequentemente, a reacção produziu sulfureto de dimetilo-d5 (12) e aldeído 11 não tratado (experiência 2).Experiência 2:

oxidação Parikh-Doering: (1967) this oxidation utilizes the pyridine sulfur trioxide complex (13) as the activator of dimethyl sulfoxide. Sulfato é o grupo de saída no deslocamento pelo álcool (primário ou Secundário) no intermediário 14. O sulfenato 15 é decomposto pelo mecanismo intramolecular (vide supra) para produzir um aldeído ou cetona.

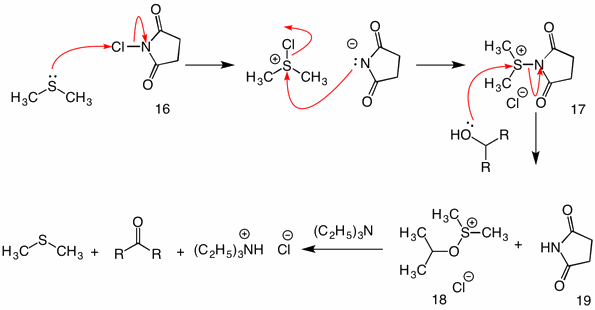
Oxidação Corey-Kim: (1972) In this procedure dimethyl sulfide is activated (oxidized) with n-chlorosuccinimide (16) to provide reagent 17. Na reação desta espécie com um álcool, o grupo succinimidilo funciona como um grupo de saída. The usual sulfenate intermediate 18 collapses by the intramolecular mechanism upon the addition of trietilamine.
oxidação de Swern: (1976) this early Swern oxidation employs trifluoroacetic anhydride (20) at-50oC to activate dimethyl sulfoxide. A adição do álcool ao intermediário 21 produz o sulfato desejado 22. A cetona ou aldeído é produzida da forma usual com trietilamina.

a Oxidação de Swern: (1978), Este mais tarde Swern procedimento é um método conveniente para a produção de reagentes 24 sem usar o dimetil sulfeto e cloro. Sulfóxido de dimetilo, que está no mesmo nível de oxidação que o sal 24, reage com cloreto de oxalilo (23) para libertar monóxido de carbono, dióxido de carbono e reagente 24. A adição do álcool primário ou Secundário seguido de desprotonação do sulfato 25 com trietilamina conduz ao aldeído desejado ou cetona, respectivamente.
