- protocolos
- Hibridoma produção
- representação Esquemática da célula de fusão
- Equipamento necessário
- meio e outros reagentes (ver Apêndice A Para mais pormenores)
- Antes de começar (consulte o Apêndice A para obter mais detalhes)
- Descongelação e o crescimento de células do mieloma
- O processo de fusão
- Três dias antes de Preparar as células do mieloma para a fusão
- um dia antes-prepare o meio
- Dia da fusão
- Day after the fusion
- Appendix I
protocolos
Hibridoma produção
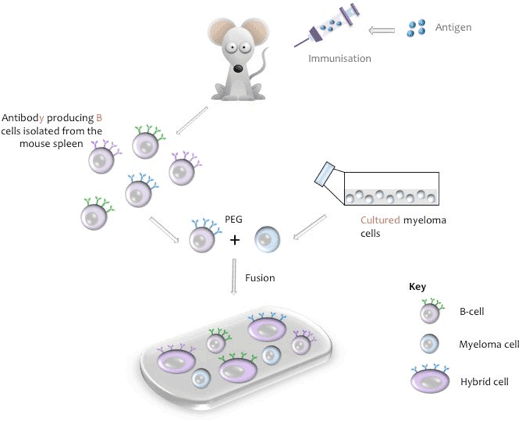
um hibridoma é uma linha celular proveniente de uma célula híbrida capaz de segregar um anticorpo monoclonal específico de um epítopo do seu antigénio permanentemente em cultura. A célula híbrida é produzida através da fusão de anticorpos específicos que produzem células B a partir de um animal imunizado (geralmente um rato, rato ou coelho) e que tem um tempo de vida finito, com uma célula a partir de uma linha de células de mieloma cultivado “imortal” (por exemplo, rato NS-1 ou NS-0).
produção de uma célula híbrida de ratinho
durante o processo de fusão, as células B são isoladas do baço de ratinho, misturadas com a linha celular do mieloma de ratinho, induzindo-se a fusão com polietilenoglicol (PEG, ver Apêndice I). (A linha mieloma relevante é utilizada quando são utilizadas células B de outras espécies animais). Os hibridomas resultantes são então cultivados em meio de cultura de tecidos contendo Hipoxatina, Aminopterina, timidina (HAT), um passo que mata qualquer célula de mieloma Não condensado que pode superar as outras células de hibridoma mais fracas. Células B Unfused têm poderes limitados da divisão e morrerão naturalmente na cultura. Dez dias após o processo de fusão, o sobrenadante da cultura é recolhido e testado para detectar a presença do anticorpo desejado.
representação Esquemática da célula de fusão
Equipamento necessário
- Um ambiente estéril, no qual para se preparar e processar células (fluxo laminar classe II, gabinete)
- Uma incubadora de definir a 37ºC, com 5% de CO2 e umidade 95%
- Um microscópio invertido
- UM 37ºC em tanque de imersão, que podem ser colocados no armário
- Uma centrífuga, com um swing-out rotor
- Estéril instrumentos de dissecação -o ideal é que dois conjuntos, cada um consistindo de dois pares de tesouras e pinças (uma curva e um blunt findo).Frascos para cultura de Corante tecidular de 75 ml-Ref. 15430641
- 24 placas de falcão de poço-Ref. 353047
- pipetas esterilizadas
- enchimento de pipetas
- pipetas Pasteur esterilizadas
- temporizador
meio e outros reagentes (ver Apêndice A Para mais pormenores)
- RPMI 1640 bicarbonato tamponado, com L-Glutamina (Ref Lonza. BE12-702F)
- RPMI 1640 Hepes tamponados, sem L-Glutamina
- soro de Boa Qualidade (testado em lote) de bovinos fetais (Ref Genycell. GCS0101-500)
- penicilina/estreptomicina (Gibco Ref. 15070-063)
- Ultroser G (Pall Ref. 15950-017)
- chapéu (Hipoxatina, Aminopterina, timidina) (Gibco Ref. 21060-017)
- PEG 1500 (Roche Ref. 10783641001)
Antes de começar (consulte o Apêndice A para obter mais detalhes)
- Fazer 500ml de Um
- Fazer 500ml de médio A+
- Fazer 100 ml de meio B
- Fazer 100 ml de meio C
- Fazer 500ml de meio D
Descongelação e o crescimento de células do mieloma
Descongele o mieloma múltiplo da linha celular e crescer em média A. Use o seguinte método para descongelar e cultura da linha celular do mieloma. Retire o frasco congelado de células do mieloma do armazenamento LN2.
O processo de fusão
Três dias antes de Preparar as células do mieloma para a fusão
As células do mieloma precisam estar em fase exponencial de crescimento, quando você usá-los e isso precisa de experiência. No entanto, se configurar dois frascos de 75 cm2 das suas células do mieloma, um a uma diluição de 1:40 e um a 1:60 (ver abaixo), 3 dias antes da fusão, um dos frascos deve ser ideal no dia da fusão. (Inicialmente, a instalação de frascos adicionais em diluições acima e abaixo das aqui indicadas deve fornecer-lhe a experiência necessária para avaliar a taxa de crescimento das células do mieloma para as perfusões subsequentes).
um dia antes-prepare o meio
a seguinte necessidade de ser feito e pré-aquecido a 37ºC (pode colocá-los na sua incubadora durante a noite).
- Dois x 200ml de médio A+ em dois 75cm2 frascos
- 100 ml de meio B
- 100 ml de meio C
- 1x4ml PEG 1500 transferidos para uma folha envolto (PEG é sensível à luz) estéril universal
- Um mini tanque de imersão, feita a partir de um copo contendo 200ml de cerca de 100ml de água destilada e cruzou com banda larga o suficiente para que haja uma abertura para segurar um Falcon de 50ml tubo vertical
Dia da fusão
- Matar o rato (seguir orientações institucionais), extrair o baço e colocá-lo em um recipiente estéril contendo 5 ml de meio C.
- todas as etapas subsequentes devem ser realizadas em uma capota laminar de fluxo.
- coloque o baço e o meio numa placa de petri.
- mova o baço com fórceps esterilizados para o Lavar. Remover quaisquer aderências e transferir o baço para uma segunda placa de petri
- cortar o baço em duas. Segure uma metade com fórceps rombo e usando outro par de fórceps curvados, cortando suavemente as células para fora da cápsula do baço, tendo o cuidado de remover o maior número de células possível. Repetir usando a segunda metade do baço
- retirar os destroços da cápsula do baço e, utilizando uma pipeta Pasteur estéril, misturar bem as células, mas muito suavemente.
- transferir a suspensão celular para um tubo de 15 ml e utilizar outro 5 ml de meio C para enxaguar a placa de petri e adicionar as células do baço no tubo.
- conte as células do mieloma e do baço. Necessita de uma razão de 1 célula de mieloma para cada 10 células de baço
- adicione as células de mieloma a um tubo cónico de 50 ml.
- centrifugar as células do baço (tubo de 15 ml) e as células do mieloma no tubo de 50 ml durante 300 g durante 10 minutos.
- Muito cuidado, despeje o sobrenadante de ambos os tubos e suavemente ressuspender o pelotas em cada 10mls de médio e B. A ausência da FBS, até que o processo de fusão é concluída é extremamente importante, pois as células não irá fundir se há FBS presente)
- Combinar a suspensão de células do baço e do mieloma múltiplo pelotas em um tubo de centrífuga de 50 ml.Centrifugar durante 5 minutos a 300g.Muito cuidadosamente derramar tanto sobrenadante quanto possível.Ressuspender o sedimento tocando suavemente o tubo no banco. Não mova a cápsula ou pipeta, pois isto irá distribuir células em torno do tubo reduzindo os números de células que estão disponíveis para a fusão.Coloque o tubo no banho de água caseiro.Adicionar 1, 2 ml de PEG gota a gota durante um minuto, agitando suavemente cada gota.
- adicionar 1 ml de B Médio, gota a gota durante um minuto, agitando suavemente cada pequena gota.Adicionar mais 2 ml de B Médio, gota a gota durante dois minutos, mexendo suavemente em cada gota .Adicionar mais 4 ml de B Médio, gota a gota durante quatro minutos, mexendo suavemente em cada gota.
- no final do tempo, adicionar 8 ml de meio C.
- centrifugar o tubo das células durante 5 minutos 300g.
- decantar cuidadosamente o sobrenadante e ressuspender a cápsula durante 1 minuto com 10 ml de meio a+. Para isso, adicione alguns ml do meio para começar a quebrar o sedimento. Sugue estes grumos de células com muita delicadeza e mova-se para cima e para baixo na pipeta. Expulse estas células e repita o processo. Seja muito gentil, não force o sedimento separado, você pode ter pequenos pedaços de células quando terminado. As células são extremamente frágeis nesta fase.O volume final é de 200 ml
- coloque 1 ml desta suspensão em cada alvéolo de 8 x 24 placas de alvéolo (2 ml). (192 poços no total)
- deixar as placas na incubadora durante a noite (cerca de 24 horas).
Day after the fusion
- Add 8ml of HAT into 200ml of medium a+.
- colocar 1 ml deste meio selectivo em cada poço das 8 placas.Deixe as placas na incubadora. As colónias aparecerão entre 7 e 10 dias.

Appendix I
Culture Medium A:
RPMI 1640 medium with L-Glutamine (bicarbonato buffered) (Lonza Ref. BE12-702F)
+ 10% de FBS (Ref.Genycell. GCS0101-500)
+ penicilina (100U / ml)/estreptomicina (100mg/l) (Gibco Ref. 15070-063)
Meio De Cultura A+:
RPMI 1640 medium with L-Glutamine (bicarbonate buffered) (Lonza Ref. BE12-702F)
+10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
+ Ultroser G (1%) (Pall Ref. 15950-017)
Culture Medium B (no FBS):
RPMI 1640 Medium with L-Glutamine (Lonza Ref. BE12-702F)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
Culture Medium C:
RPMI 1640 Medium with L-Glutamine (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
Culture Medium D:
RPMI 1640 medium with L-Glutamine (bicarbonate buffered) (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
+ Ultroser G (1%) (Pall Ref. 15950-017)
+ HAT (Hypoxathine, Aminopterin, Thymidine) supplement which is usually 50X (dilute 10ml in 500mls of medium) (Gibco Ref. 21060-017)