Ionielektrolyytit
vesi ja muut polaariset molekyylit vetävät puoleensa ioneja, kuten kuvassa \(\PageIndex{2}\). Ionin ja molekyylin, jolla on dipoli, välistä sähköstaattista vetovoimaa kutsutaan ioni-dipoli-vetovoimaksi. Näillä houkutuksilla on tärkeä rooli ioniyhdisteiden liukenemisessa veteen.
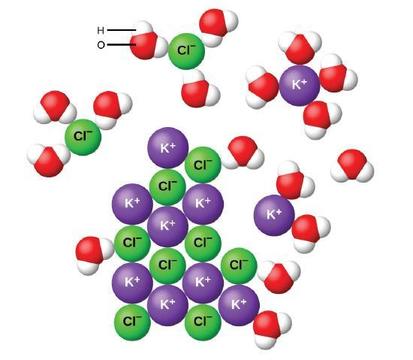
kun ioniyhdisteet liukenevat veteen, kiinteän aineen ionit erkanevat ja hajoavat tasaisesti koko liuokseen, koska vesimolekyylit ympäröivät ja liuottavat ioneja vähentäen niiden välisiä voimakkaita sähköstaattisia voimia. Tämä prosessi edustaa fyysistä muutosta, jota kutsutaan dissosiaatioksi. Useimmissa olosuhteissa ioniyhdisteet hajoavat liuetessaan lähes kokonaan, joten ne luokitellaan vahvoiksi elektrolyyteiksi.
tarkastellaan, mitä tapahtuu mikroskooppisella tasolla, kun veteen lisätään kiinteää KCl: ää. Ioni-dipoli-voimat vetävät puoleensa polaaristen vesimolekyylien positiivisen (vety) pään kiintoaineen pinnalla oleville negatiivisille kloridi-ioneille, ja ne vetävät negatiiviset (happi) päät positiivisille kaliumioneille. Vesimolekyylit tunkeutuvat yksittäisten K+− ja Cl-ionien väliin ja ympäröivät niitä, jolloin ioneja yhteen sitovat vahvat interioniset voimat vähenevät ja ne siirtyvät liukenevina ioneina pois liuoksesta, kuten kuva osoittaa. Sähköstaattisen vetovoiman väheneminen mahdollistaa jokaisen hydratoidun ionin itsenäisen liikkeen laimeassa liuoksessa, mikä johtaa järjestelmän epäjärjestyksen lisääntymiseen ionien muuttuessa kiinteästä ja järjestetystä asennostaan kiteessä liikkuviin ja paljon sekavampiin tiloihin liuoksessa. Tämä lisääntynyt häiriö on vastuussa monien ioniyhdisteiden, kuten KCL: n liukenemisesta, jotka liukenevat lämmön imeytyessä.
muissa tapauksissa Kiteen ionien väliset sähköstaattiset vetovoimat ovat niin suuria tai ionien ja vesimolekyylien väliset ionidipolin vetovoimat ovat niin heikkoja, että epäjärjestyksen lisääntyminen ei pysty kompensoimaan ionien erottamiseen tarvittavaa energiaa, ja kide on liukenematon. Tällaisia yhdisteitä ovat esimerkiksi kalsiumkarbonaatti (kalkkikivi), kalsiumfosfaatti (luun epäorgaaninen komponentti) ja rautaoksidi (ruoste).