Dimethyl Sulfoxide Oxidations
Dimethyl sulfoxide-based oxidation of primary alcohols to aldehydes or secondary alcohols to ketones is a mild method that does not depend upon heavy metal oxidants. Here is a brief, chronological history of the procedure.
Index:
-
Swern Oxidation (trifluoroacetic anhydride)
-
Swern Oxidation (oxalyl chloride)
Kornblum Oxidation: (1959) primaarinen tosylaatti kuumennetaan 150o: ssa, jolloin dimetyylisulfoksidin (DMSO) happi aiheuttaa SN2: n siirtymisen NaHCO3: n läsnä ollessa. Tuolloin hyväksytty mekanismi oli E2-eliminaatio, kuten on esitetty. Dimetyylisulfidi (DMS) on reaktion pelkistystuote. Tämä työ muodosti tosylaatin alkyylijodidista hopeatosylaatin kanssa. Oletettavasti tosylaatti voidaan valmistaa alkoholista, joka on suorempi reitti. Menettelyn haittapuolena on kohonnut lämpötila, vaikka kosketusaika on vain muutamia minuutteja. Olennaista on löytää menetelmä sulfenaattisuolan tuottamiseksi.

Barton Modification: (1964) Barton ja työtoverit pystyivät tuottamaan sulfenaattisuoloja käsittelemällä alkyylikloroformaatteja DMSO: lla, jolloin hiilidioksidi hävisi. Trietyyliamiinin lisääminen tuottaa hapetustuotteen. Tämä menettely paransi ankarat olosuhteet Kornblum menettely. Lisäksi kloroformaattia on helposti saatavilla käsittelemällä alkoholia hapetettavaksi ylimääräisellä fosgeenilla.

Moffatt-Pfitzner-Hapetus: (1963) Syntexissä kehitettiin tämä dimetyylisulfoksidipohjaisen hapetuksen muunnos. Aktivaattoria valmistetaan protonoimalla disykloheksyylikarbodi-imidia (1, DCC), jonka kimppuun dimetyylisulfoksidi hyökkää. Intermediate 2 protonoidaan jälleen helpottamaan alkoholihapen lisäämistä rikkiatomiin. Stabiilia disykloheksyyliurea 4: ää muodostuu yhdessä sulfenaattisuola 3: n kanssa. Tämä laji romahtaa karbonyyliyhdisteeksi divetyfosfaattianionin vaikutuksesta. Vaikka fosforihappo on tehokas happokatalyytti tässä reaktiossa, rikkihappo, vetykloridi ja trifluorietikkahappo eivät ole. Pyridiniumtrifluoriasetaatti on kuitenkin tehokas katalyytti. On ratkaisevaa, että hapon konjugaattiemäs on riittävän emäksinen reaktion viimeisen vaiheen aikaansaamiseksi.

Torrsellin mekanismi: (1966) ruotsalainen kemisti Torrsell osoitti, että näiden DMSO-pohjaisten hapetusten mekanismi ei etene molekyylien välisen β-eliminaation kautta. Eliminaatio on intramolekulaarinen prosessi. Sulfenaattisuola 5 valmistettiin Moffatt-Pfitzner-menetelmällä (KS.edellä). Jos Kornblum-mekanismia sovellettaisiin, saadusta dimetyylisulfidista puuttuisi deuterium (Koe 1). Kuitenkin saatiin dimetyylisulfidi-d1 (7). Tulos on yhtäpitävä emäksen kanssa, joka deprotonoi rikkiin kiinnittyneen metyyliryhmän muodostaen ylidin 6. Ylidi hajoaa intramolekulaarisessa deprotonaatiossa Havaittujen tuotteiden tuottamiseksi.
Koe 1:

tämän mekanismin vahvistamiseksi deuterium liitettiin DMSO: han DMSO-D6: na. Näin reaktiossa syntyi dimetyylisulfidi-d5 (12) ja puhdistamaton aldehydi 11 (Koe 2).
Koe 2:

Parikh-Doering Oxidation: (1967) tämä hapetus käyttää pyridiini-rikkitrioksidikompleksia (13) dimetyylisulfoksidin aktivaattorina. Sulfaatti on alkoholin (primäärisen tai sekundäärisen) siirtymän poistuva ryhmä väli-14: ssä. Sulfenaatti 15 hajoaa intramolekulaarisella mekanismilla (vide supra), jolloin muodostuu aldehydi tai Ketoni.

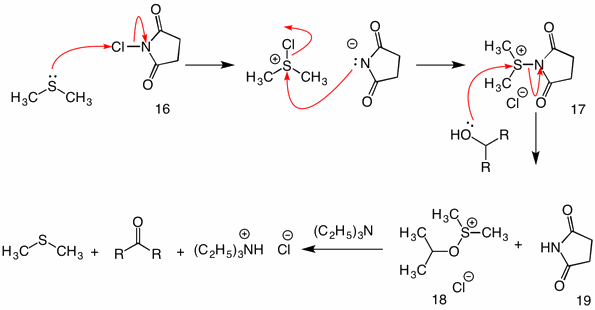
Corey-Kim Hapetus: (1972) tässä menetelmässä dimetyylisulfidi aktivoidaan (hapetetaan) N-kloorisukkiini-imidin (16) kanssa reagenssiksi 17. Tämän lajin reaktiossa alkoholin kanssa sukkinimidyyliryhmä toimii lähtevänä ryhmänä. Tavallinen sulfenaattiväli 18 romahtaa intramolekulaarisen mekanismin vaikutuksesta trietyyliamiinin lisätessä sitä.
Swern Oxidation: (1976) tämä varhainen Swern oxidation käyttää trifluorietikkahappoanhydridiä (20) at-50oC aktivoidakseen dimetyylisulfoksidin. Lisäämällä alkoholia väli-21: een saadaan haluttu sulfenaatti 22. Ketonia tai aldehydiä valmistetaan tavalliseen tapaan trietyyliamiinin avulla.

Swern Oxidation: (1978) tämä myöhempi Swern-menetelmä on kätevä menetelmä reagenssi 24: n valmistamiseksi ilman dimetyylisulfidia ja klooria. Dimetyylisulfoksidi, joka on samalla hapetusasteella kuin suola 24, reagoi oksalyylikloridin (23) kanssa vapauttaen hiilimonoksidia, hiilidioksidia ja reagenssia 24. Primäärisen tai sekundäärisen alkoholin lisääminen, jota seuraa sulfenaatti 25: n deprotonointi trietyyliamiinin kanssa, johtaa haluttuun aldehydiin tai ketoniin.
