22. syyskuuta 2017, NCI: n henkilökunta
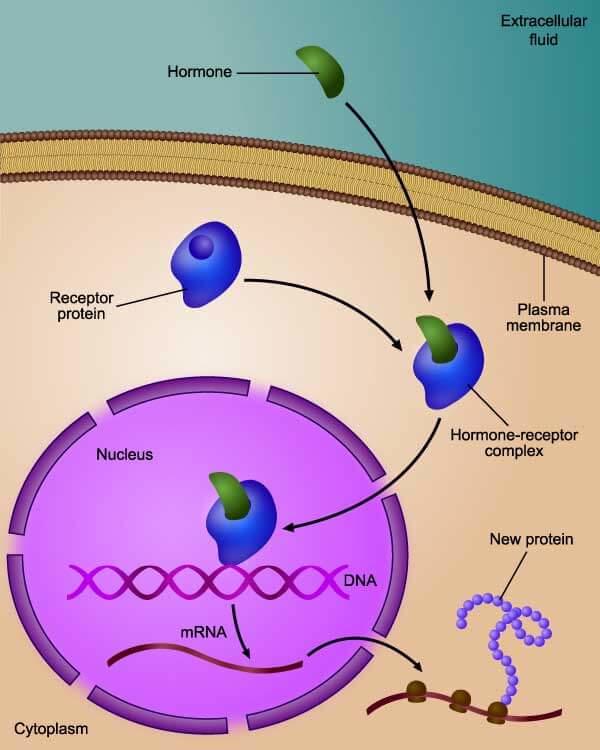
fulvestrantti toimii sitoutumalla estrogeenihormonin rintasyöpäsolujen reseptoriin ja lopulta hajottamalla sen, mikä auttaa estämään kasvaimen kasvua ruokkivia prosesseja.
Elokuun 28. päivänä Food and Drug Administration (FDA) laajensi estrogeenia estävän lääkkeen fulvestrantin (Faslodex®) hyväksyntää joillekin naisille, joilla on pitkälle edennyt rintasyöpä.
lääkkeen Uusi käyttöaihe on itsenäisenä hoitona tai monoterapiana postmenopausaalisille naisille, joilla on pitkälle edennyt hormonireseptori (HR)-positiivinen, HER2-negatiivinen rintasyöpä, joille ei ole aiemmin tehty hormonihoitoa.
fulvestrantti on jo hyväksytty kahteen muuhun käyttöön rintasyöpää sairastavilla naisilla: itsenäisenä hoitona postmenopausaalisille naisille, joilla on HR-positiivinen metastaattinen rintasyöpä, jonka tauti eteni muun antiestrogeenihoidon jälkeen, ja yhdessä CDK4/6-estäjän palbociklibin (Ibrance®) kanssa pitkälle edenneen tai metastasoituneen HR-positiivisen, HER2-negatiivisen rintasyövän hoitoon, joka on edennyt hormonihoidon jälkeen.
”fulvestrantti on kehittymässä tehokkaimmaksi yhden lääkkeen hoidoksi tässä tilanteessa, mikä on aiemmin osoitettu potilailla, joita oli hoidettu aromataasin estäjillä, ja nyt potilailla, joita ei ole aiemmin hoidettu hormonihoidolla”, sanoi Massimo Cristofanilli Northwestern-yliopiston Robert H. Lurie Comprehensive Cancer Centeristä.
hyväksyntä, joka perustui parantuneeseen taudin Etenemisvapaaseen elinaikaan
laajennettu hyväksyntä perustui vaiheen 3 tutkimuksen tuloksiin, joihin osallistui 462 postmenopausaalista naista, joilla oli HR-positiivinen pitkälle edennyt tai metastasoitunut rintasyöpä ja jotka eivät olleet aiemmin saaneet hormonihoitoa. Tutkimuksen naiset satunnaistettiin saamaan joko fulvestranttia tai aromataasi-inhibiittoria anastrotsolia (Arimidex®).
aromataasin estäjät vaikuttavat vähentämällä kasvainsolujen käytettävissä olevaa estrogeenia. Fulvestrantti vaikuttaa estämällä estrogeenin sitoutumisen syöpäsoluihin.
tutkimuksen ensisijainen päätetapahtuma oli mediaani ilman taudin etenemistä. Fulvestranttiryhmässä elossaoloaika ilman taudin etenemistä (mediaani) oli 16, 6 kuukautta ja anastrotsoliryhmässä 13, 8 kuukautta.
Tri Cristofanilli totesi, että yksi potilasryhmä näytti hyötyvän enemmän kuin muut: potilailla, joiden syöpä ei ollut levinnyt kehon pehmeisiin sisäelimiin (ts.niillä, joilla oli ei-sukupuolinen sairaus) oli huomattavasti parempi eloonjäämisaste ilman taudin etenemistä: 22, 3 kuukautta fulvestrantilla, kun taas 13, 8 kuukautta anastrotsolilla. Sen sijaan niillä, joiden syöpä oli levinnyt sisäelimiin, taudin etenemisvapaan elinajan paraneminen oli paljon vähäisempää: 15, 9 kuukautta verrattuna 13, 8 kuukauteen.
tämä löydös voisi mahdollisesti auttaa lääkäreitä suunnittelemaan hoitoa potilaille, joiden tauti osoittaa merkkejä leviämisestä ensiesittelyssä, tohtori Cristofanilli sanoi.
yleisimmät haittavaikutukset fulvestrantilla hoidetuilla naisilla olivat nivelkipu, väsymys, kuumat aallot ja pahoinvointi.
valinta fulvestrantin ja CDK4/6: n estäjien välillä
Dr. Cristofanilli selitti, että pitkälle edenneen HR-positiivisen rintasyövän hoito monimutkaistuu, kun tutkijat oppivat lisää hormonihoidon vastustuskyvyn mekanismeista ja kun äskettäin hyväksytyt lääkkeet osoittavat kyvyn parantaa tuloksia näitä syöpiä sairastaville naisille.
tässä tilanteessa, hän lisäsi, fulvestrantti on kehittymässä tehokkaaksi yhden lääkkeen hoidoksi. ”Mielestäni tämä hyväksyntä tarjoaa erinomaisen, turvallisen ja tehokkaan vaihtoehdon näille potilaille, jotka perustuvat vankkoihin mahdollisiin kliinisiin tietoihin”, hän sanoi.
naisille, joilla on toistuva HR-positiivinen rintasyöpä, yhdistelmähoidot, jotka sisältävät cdk4/6-estäjiksi kutsuttuja täsmähoitoja hormonihoidon kanssa, ovat nousseet hoidon standardiksi, tohtori Cristofanilli jatkoi.
kuitenkin ”fulvestrantti näyttää tarjoavan vaihtoehtoisen vaihtoehdon naisille, joilla on äskettäin diagnosoitu HR-positiivinen rintasyöpä, joka ei ole koskaan altistunut hormonihoidolle”, hän sanoi. ”Kyseessä on todennäköisesti ryhmä todellisia umpieritysherkkiä potilaita, jotka eivät välttämättä tarvitse tai hyödy aggressiivisemmista hoidoista .”