Background
Hashimoton enkefalopatia (HE) on harvinainen neuropsykiatrinen oireyhtymä, joka liittyy kilpirauhasen vasta-aineisiin ja jonka Brain raportoi ensimmäisen kerran vuonna 1996 (Brain et al., 1966). Hänellä on laaja valikoima kliinisiä oireita, mukaan lukien neurologiset oireet, kuten aivohalvauksen kaltaiset jaksot, kouristukset, sekavuus, myoklonus, ataksia, vapina ja dementia, sekä psykiatriset ilmenemismuodot, mukaan lukien akuutti psykoosi, masennushäiriöt, persoonallisuuden muutokset, hallusinaatiot ja skitsofrenia (Kirshner, 2014; Menon et al., 2017). Tässä tapausraportissa kuvaillaan potilasta, jonka kliiniset oireet ja laboratoriotulokset jäljittelivät virusaivotulehdusta.
tapausselostus
sairaalaan otettiin 59-vuotias mies, jolla oli kuumetta, päänsärkyä ja hankalaa puhetta, joka erityisesti ilmeni hitaana ja epäselvänä puheena. Hän kiisti viimeaikaiset infektiot, kuten flunssa tai gastroenteriitti, matkustus, ja muut mahdolliset syyt, jotka voisivat olla vastuussa kuume, joka oli korkeimmillaan 39,5°C. aiempi sairaushistoria paljasti kihti 20 vuotta, mutta lääkkeitä ei määrätty. Hänen neurologinen tutkimus ja kallon tietokonetomografia (TT) ja magneettikuvaus (Kuva 1) olivat normaalit. EEG-tulokset osoittivat pieniä epäsäännöllisyyksiä molemminpuolisesta pallonpuoliskosta lähtevissä aalloissa (5-20 µv 14-20 Hz β). Veren rutiini, C-reaktiivinen proteiini, seerumin B12-vitamiini ja foolihappo sekä muut autoimmuunitautien tekijät, jotka sisältävät tumavasta-ainetta (ANA), neutrofiilien sytoplasmivasta-aineita (ANCA) ja nivelreumatekijöitä, olivat kaikki merkityksettömiä. Aivo-selkäydinnesteessä todettiin lisääntynyt valkosolujen määrä (104 × 106/L, viitealue 0–8 × 10^6/L) ja kohonneet proteiinipitoisuudet (1, 68 g/L, vertailualue 0, 15-0, 45 g / L). Seerumin ja aivo-selkäydinnesteen vasta-aineet olivat negatiivisia. Hänellä diagnosoitiin virusaivotulehdus ja häntä hoidettiin viruslääkkeillä. Hänen oireensa helpottivat viikossa ja hän pääsi pois sairaalasta. Viisi kuukautta myöhemmin hänet siirrettiin jälleen sairaalaamme 38,5°C: n kuumeen ja satunnaisen tuomion sekavuuden vuoksi. Toinen lannepisto tehtiin; aivo-selkäydinnesteen valkosolujen määrä oli 39 × 10^6/L ja proteiinipitoisuus oli 1,32 g / L. Kallon magneettikuvaus ja laboratoriokokeiden tulokset olivat lähes normaalit lukuun ottamatta kilpirauhasen toiminnan heikkenemistä ja seerumin ja aivo-selkäydinnesteen kohonneita Anti-kilpirauhasen autoantibody (ATA) – tasoja. Ensimmäiset löydökset olivat seuraavat: seerumissa kilpirauhasta stimuloivan hormonin (TSH) pitoisuus oli 43, 39 uIU/ml (viitealue (RR): 0, 27–4, 2 uIU/ml), vapaan trijodityroniinin (FT3) pitoisuus oli 2, 89 pmol/ml (rr: 3, 1–6, 8 pmol/ml), vapaan tyroksiinin (FT4) pitoisuus oli 7, 18 pmol/ml (RR: 12, 0–22, 0 pmol/ml), trijodityroniinin (TT3) kokonaispitoisuus oli 1, 17 pmol/ml (RR: 1, 3–3.1 pmol/ml), and total thyroxine (TT4) concentration was 44.26 pmol/ml (RR: 66–181 pmol/ml); the titer of anti-thyroglobulin autoantibodies (TgAb) was 1274 IU/ml (RR: < 115 IU/ml) and the titer of anti-thyroperoxidase autoantibodies (TPOAb) was 600 IU/ml (RR: < 35 IU/ml). In the CSF, ATA was positive (TPOAb 17.06 IU/ml, TgAb 16.02 IU/ml). Ultrasound imaging indicated diffuse lesions of the thyroid. Vasta-aineanalyysit anti-NMDAR, AMPA1, AMPA2, LGI1, CASPR2, GABA, GAD, anti-Hu, Yo, Ri, MAI, MA2, CV2, Amfifysiini, SOX-1, Tr, Zic4 ja GAD65 olivat kaikki negatiivisia sekä seerumissa että aivo-selkäydinnesteessä. Potilaalle diagnosoitiin lopulta HE, Hashimoton kilpirauhasen vajaatoiminta ja kilpirauhasen vajaatoiminta ja hänelle määrättiin metyyliprednisolonia ja Eutyroksia. Metyyliprednisolonia aloitettiin annoksella 80 mg / vrk 1 viikon ajan ja vähennettiin 40 mg / vrk 2 viikon aikana; myöhemmin määrättiin oraalinen prednisoloni, joka vieroitettiin nopeudella 5 mg viikossa, eli oraalista prednisolonia käytettiin yhteensä 8 viikon ajan. Oireet lievittyivät kolmessa päivässä. Potilas pysyi terveenä 1 vuoden pituisen seurantajakson ajan.
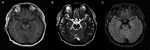
Kuva 1. Aivojen magneettikuvaus. Potilaan aivojen magneettikuvauksessa ei ole havaittu poikkeavia löydöksiä. A) T1-painotettu kuva; B) T2-painotettu kuva; C) hohtava kuva.
Keskustelu
hänen arvioitu esiintyvyys on 2, 1 100 000:sta ja sukupuolisuhde (naisen ja miehen suhde) on 4: 1 (Ferracci ym., 2004). Hänen kurssinsa voi olla etenevä, relapsoivasti ilmenevä tai jopa itseään rajoittava. Tässä tapauksessa potilaalla näytti olevan relapsoiva-ilmenevä kurssi.
yhdistettynä potilaan oireisiin, normaaleihin MAGNEETTIKUVAUSTULOKSIIN, seerumin korkeisiin ATA-tittereihin ja aivo-selkäydinnesteen ATA-positiivisuuteen potilaalla todettiin lopulta HE-tauti sen jälkeen, kun muut mahdolliset syyt, kuten aivohalvaus, kasvain, keskushermostoinfektio, autoimmuunitulehdus ja paraneoplastinen oireyhtymä, oli suljettu pois.
kaiken kaikkiaan hänen patofysiologiastaan ei ole vielä täyttä varmuutta. Neuropatologisten löydösten perusteella on ehdotettu autoimmuunivaskuliittimekanismia. Aiemmassa tutkimuksessa, aivojen koepaloja paljasti, että lymfosyyttinen infiltraatio ympärillä venules ja arteriolit voivat olla mukana (Duffey et al., 2003). Toinen mahdollinen mekanismi on, että atas hyökkäys antigeenejä, jotka ovat yhteisiä kilpirauhasen ja aivojen, ja tästä syystä korkea tiitterit ATAs lukien tpoab, TgAb, ja anti-TSH reseptori (TSH-R) vasta-aineita seerumissa, ja joskus CSF, pidetään tunnusmerkki piirteitä HE (Yoneda, 2018). Samoin ATA: n ja CSF-ATA: n korkeat tiitterit havaittiin meidän tapauksessamme. Edellisessä tutkimuksessa plasmanvaihtohoito paransi potilaiden oireita huomattavasti (Tran ym., 2018). Yhdessä nämä havainnot viittaavat siihen, että Atalla on tärkeä rooli hänessä. Seerumin kohonneita ATA-pitoisuuksia esiintyy kuitenkin myös yleisväestöllä ja ne ovat erityisen yleisiä iäkkäillä henkilöillä. Lisäksi ATA: n kohoamisen laajuus ei ole yhteydessä hänen vakavuuteensa. Vaikka potilaiden seerumin ATA-tasot pysyivät korkeina metyyliprednisolonihoidon jälkeen, oireet hävisivät (tyreoglobuliinin autovasta-ainetitteri (TgAb): 041 IU / ml, RR: < 115 IU/ml; tiroperoksidaasiautovasta-aineiden titteri: 600 IU/ml, RR: <35 IU / ml). Tuloksemme vahvistavat, ettei ATA: n korkeuden ja hänen vakavuutensa välillä ole yhteyttä.
vaikka ATA: n ja hänen välinen korrelaatio on vielä epäselvä (Kirshner, 2014), Lancetin neurologian asiantuntijaryhmä ehdotti hänelle diagnostisia kriteerejä vuonna 2016. Kriteerit ovat seuraavat: (1) enkefalopatia, johon liittyy kouristuskohtauksia, myoklonusta, hallusinaatioita tai aivohalvauksen kaltaisia jaksoja; (2)subkliininen tai lievä kilpirauhasen sairaus (yleensä kilpirauhasen vajaatoiminta); (3) normaalit löydökset tai epäspesifiset poikkeavuudet, joita aivojen magneettikuvaus osoittaa; (4) kilpirauhasen vasta-aineiden esiintyminen seerumissa (kilpirauhasperoksidaasi, tyroglobuliini); (5) hyvin tunnettujen neuronaalisten vasta-aineiden puuttuminen seerumista ja aivo-selkäydinnesteestä; ja (6) vaihtoehtoisten syiden kohtuullinen poissulkeminen. Hänet voidaan diagnosoida, jos potilas täyttää kaikki kriteerit (Graus et al., 2016). Potilaamme täytti kaikki edellä mainitut kriteerit,ja siksi hänet voitiin diagnosoida. Useimmat potilaat, joilla hän reagoi hyvin steroideihin; kun potilaat ovat steroidiresistenttejä, muiden immunosuppressiohoitojen, kuten plasmanvaihdon, IVIg: n, metotreksaatin ja mykofenolaatin, on kuitenkin osoitettu olevan tehokkaita. Metyyliprednisolonia (500-1000 mg) käytetään useimmiten suurina annoksina. Koska potilas osoitti lieviä oireita ja kieltäytyi suuren metyyliprednisoloniannoksen käytöstä, määräsimme pienen annoksen metyyliprednisolonia. Potilaallemme tehtiin steroidihoitoa ja hän on sen jälkeen pysynyt terveenä. Potilas ei saanut muita immunoterapiahoitoja seurannan aikana. Vuonna retrospektiivinen observational tutkimus suoritetaan Mamoudjy et al. (2013) tutkimustulokset osoittivat, että jotkut HE-potilaat kokivat relapsin, jopa kolmannen kohtauksen, jolla oli lyhyempi aikaväli (keskiarvo 18 päivää) verrattuna toiseen kohtaukseen (keskiarvo 213 päivää). Relapsipotilaat tarvitsivat uudelleen metyyliprednisolonia tai immunosuppressiivista hoitoa (Mamoudjy ym., 2013). Potilaamme sai yhden uusiutumisen noin 150 päivää ensimmäisen kohtauksen jälkeen ja steroidihoito oli tehokasta. Myös jälkitaudit, kuten päänsärky, muistisairaudet ja niin edelleen, olivat yleisiä (Mamoudjy ym., 2013), mutta potilaallamme ei onneksi ollut jälkiseurauksia jäljellä.
Hashimoton enkefalopatiaa on vaikea diagnosoida tarkasti, koska siihen liittyy monenlaisia kliinisiä oireita sekä epäspesifinen neuroimagointi ja aivosähkökäyräesitys. Edellisessä artikkelissa kerrottiin tapaus hän, joka oli aluksi virheellisesti diagnosoitu virus enkefaliitti (hän et al., 2013), jossa potilaalla oli asteittain heikentynyt kognitiivinen toiminta ja hallitsemattomat kohtaukset ilman kuumetta. Meidän tapauksessamme lisääntynyt valkosolujen määrä ja CSF-proteiini yhdistettynä kuumeeseen ja päänsärkyyn johtavat meidät diagnosoimaan sen virusaivotulehdukseksi. Kuumetta on kuvattu useilla potilailla, joilla on tai ei ole kilpirauhasen toimintahäiriöitä (Huang et al., 2011; Lu et al., 2015). Vaikka syy kuume hän on epäselvä, Lu et al. (2015) ehdotti, että se voi olla suora seuraus tulehduksesta yhdistettynä autoimmuunivaskuliittiin.
Hashimoton enkefalopatia voi ilmetä monilla eri tavoilla, mukaan lukien aivohalvauksen kaltaiset kohtaukset, kouristukset, sekavuus, myoklonus, akuutti psykoosi, masennushäiriöt ja hallusinaatiot, jolloin hänet sekoitetaan muihin sairauksiin. Uwatoko ym. (2018) kertoi tapauksesta, jossa potilas esitti parkinsonismia ja aivojen magneettikuvauksessa paljastunutta kasvainmaista vammaa. Koepalan jälkeen todettiin, että vaurio ei ollutkaan kasvain, ja lopulta se varmistui (Uwatoko et al., 2018). Potilaat, joilla hän voi myös esittää epätavallisia oireita, kuten pseudobulbar palsy, sensorimotor polyneuropatia, katatoniset oireet, huimaus, lihasheikkous, chorea, opsoclonus, ja kolmoishermosärky tyyppi päänsärky, muun muassa (Beckmann et al., 2011; Salazar et al., 2012; Sharan et al., 2015; Ueno et al., 2016; Karthik et al., 2017; Emeksiz et al., 2018; Oz Tuncker et al., 2018). Nopeasti etenevä dementia, joka on hänen yhteinen ilmentymänsä, tekee välttämättömäksi erottaa hänet muista verisuonten, tarttuvien, toksis-metabolisten ja autoimmuunitekijöiden aiheuttamista sairauksista, etäpesäkkeistä/neoplasioista, iatrogeenisista / synnynnäisistä aineenvaihdunnan virheistä, neurodegeneratiivisista sairauksista ja systeemisistä sairauksista/kohtauksista (Paterson et al., 2012).
johtopäätös
johtopäätöksenä hänen diagnoosinsa on melko monimutkainen, mutta arvokas, koska sillä on dramaattinen vaste immunosuppressiiviselle hoidolle. Kun kliinikot kohtaavat selittämättömän aivotulehduksen, kilpirauhasen toimintaa ja ATA-arvoja olisi pidettävä tavanomaisina testeinä. Hänet voidaan sulkea pois diagnoosina potilailla, joilla on normaali ATA-pitoisuus seerumissa. Jos potilaalla on kohonnut ATA-pitoisuus, hänen tilaansa on harkittava sen jälkeen, kun muut mahdolliset sairaudet on suljettu pois.
tiedon Saatavuuslausunto
tätä tutkimusta varten luodut aineistot ovat pyynnöstä vastaavan tekijän saatavilla.
eettinen lausunto
ihmisosallistujien tutkimukset tarkastettiin ja hyväksyttiin Kiinan Jilinin yliopiston ensimmäisen sairaalan eettisessä komiteassa. Potilaat / osallistujat antoivat kirjallisen tietoon perustuvan suostumuksensa osallistua tähän tutkimukseen. Henkilöltä(henkilöiltä) on saatu kirjallinen suostumus tähän artikkeliin sisältyvien mahdollisesti tunnistettavien kuvien tai tietojen julkaisemiseen.
Tekijäosuudet
HM osallistuivat käsikirjoituksen laatimiseen ja suunnitteluun. Minun kirjoitti käsikirjoituksen ensimmäisen luonnoksen. YY, XM, YX ja NS kirjoittivat osia käsikirjoituksesta. Kaikki kirjoittajat osallistuivat käsikirjoituksen tarkistamiseen, lukivat ja hyväksyivät toimitetun version.
Rahoitus
tätä työtä tuki National Key R&D Program of China (No. 2017yfc0110304).
eturistiriita
kirjoittajat toteavat, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, joita voitaisiin pitää mahdollisena eturistiriitana.
Beckmann, Y. Y., Top, D., and Yigit, T. (2011). Epätavalliset esitykset Hashimoton enkefalopatiasta: kolmoisneuralgiaforminen päänsärky, vinoutunut poikkeama, hypomania. Umpieritys 40, 495-496. doi: 10.1007 / s12020-011-9506-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Brain, L., Jellinek, E. H., And Ball, K. (1966). Hashimoton tauti ja enkefalopatia. Lancet 2, 512-514.
Google Scholar
Duffey, P., Yee, S., Reid, I. N., and Bridges, L. R. (2003). Hashimoton enkefalopatia: postmortem findings after fatal status epilepticus. Neurologia 61, 1124-1126.
PubMed Abstract / Google Scholar
Emeksiz, S., Kutlu, N. O., Alacakir, N., and Caksen, H. (2018). Hashimoton enkefalopatia ja sensorimotorinen polyneuropatia. Turk. J. Pediatr. 60, 310–314. doi: 10.24953/turjped.2018.03.012
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferracci, F., Bertiato, G., and Moretto, G. (2004). Hashimoton enkefalopatia: epidemiologic data and pathogenetic considerations. J. Neurol. Sci. 217, 165–168.
PubMed Abstract / Google Scholar
Graus, F., Titulaer, M. J., Balu, R., Benseler, S., Bien, C. G., Cellucci, T., et al. (2016). Kliininen lähestymistapa autoimmuunitulehduksen diagnosointiin. Lancet Neurol. 15, 391–404.
Google Scholar
He, L., Li, M., Long, X. H., Li, X. P., and Peng, Y. (2013). Hashimoton enkefalopatia diagnosoitiin väärin virusaivotulehdukseksi. On. J. Asia Rep. 14, 366-369.
Google Scholar
Huang, W., Xia, C., and Chatham, M. (2011). Tartuntatauti tai Hashimoton enkefalopatia: tapausraportti. Kohtaus 20, 717-719. doi: 10.1016 / J.takavarikko.2011.04.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Karthik, M. S., Nandhini, K., Subashini, V., and Balakrishnan, R. (2017). Hashimoton enkefalopatia, jossa esiintyy epätavallisia käytöshäiriöitä teinitytöllä. Case Rep. Med. 2017, 3494310. doi: 10.1155/2017/3494310
PubMed Abstrakti / CrossRef kokoteksti / Google Scholar
Kirshner, H. S. (2014). Hashimoton enkefalopatia: lyhyt katsaus. Kurr. Neurol. Neurotieteilijä. 14: 476.
Google Scholar
Lu, T., Zhou, Z., Wu, A., Qin, B., and Lu, Z. (2015). Kuumeinen Hashimoton enkefalopatia liittyy Hashitoksikoosiin. Acta Neurol. Belg. 115, 811–813.
Google Scholar
Mamoudjy, N., Korff, C., Maurey, H., Blanchard, G., Steshenko, D., Loiseau-Corvez, M. N., et al. (2013). Hashimoton enkefalopatia: tunnistaminen ja pitkän aikavälin tulos lapsilla. Euro. J. Paediatr. Neurol. 17, 280–287. doi: 10.1016/j.ejpn.2012.11.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Menon, V., Subramanian, K., and Thamizh, J. S. (2017). Psychiatric presentations heralding Hashimoto ’ s encephalopathy: a systematic review and analysis of cases reported in literature. J. Neurotutkija. Maaseudulla. Praktia. 8, 261–267. doi: 10.4103 / jnrp.jnrp_440_16
PubMed Abstract | CrossRef Full Text | Google Scholar
Oz Tuncker, G., Teber, S., Kutluk, M. G., Albayrak, P., and deda, G. (2018). Hashimoton enkefalopatia esiintyy pseudobulbaarisena halvauksena. Childs Nerv. Syst. 34, 1251–1254. doi: 10.1007 / s00381-018-3720-2
PubMed Abstrakti / CrossRef kokoteksti / Google Scholar
Paterson, R. W., Takada, L. T., and Geschwind, M. D. (2012). Nopeasti etenevien dementioiden diagnosointi ja hoito. Neurol Clin. Praktia. 2, 187–200.
PubMed Abstract / Google Scholar
Salazar, R., Mehta, C., Zaher, N., and Miller, D. (2012). Opsoklonus Hashimoton enkefalopatian ilmentymänä. J. Clin. Neurotieteilijä. 19, 1465–1466. doi: 10.1016 / j.jocn.2012.02.012
PubMed Abstract | CrossRef Full Text | Google Scholar
Sharan, A., Sengupta, S., Mukhopadhyay, S., and Ghosh, B. (2015). Hashimoton enkefalopatia esiintyy Chorean kanssa. J. Assoc. Physicians India 63, 83-84.
PubMed Abstract / Google Scholar
Tran, M. H., Mkhikian, H., Sy, M., Perez-Alvarez, I., and Demetriou, M. (2018). Pitkäaikainen plasmanvaihto ylläpitohoitona pikkuaivojen tyyppiselle Hashimoton enkefalopatialle, kertoo tapausraportti. Verensiirto. Apher. Sci. 57, 418–420. doi: 10.1016 / J.transci.2018.05.027
PubMed Abstract | CrossRef Full Text | Google Scholar
Ueno, H., Nishizato, C., Shimazu, T., Watanabe, H., Mizukami, T., Kosuge, H., et al. (2016). Hashimoton enkefalopatiaan liittyy huimausta ja lihasheikkoutta miespotilaalla. Ei Hattatsu 48, 45-47.
PubMed Abstract / Google Scholar
Uwatoko, H., Yabe, I., Sato, S., Abe, M., Shirai, S., Takahashi, I., et al. (2018). Hashimoton enkefalopatia jäljittelee aivokasvainta ja sen patologisia löydöksiä: tapausraportti. J. Neurol. Sci. 394, 141–143. doi: 10.1016 / j.jns.2018.09.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoneda, M. (2018). Hashimoton enkefalopatia ja autovasta-aineet. Brain Nerve 70, 305-314. doi: 10.11477 / mf.1416201004
PubMed Abstract | CrossRef Full Text / Google Scholar